Защитные покрытия для меди и медных сплавов
Медь – один из самых распространённых металлов в гальванотехнике. Медное покрытие мягкое, красноватого цвета, довольно пластичное, хорошо поддается пайке. Кроме того, медь – прекрасный проводник электричества. Тем не менее, для окончательных покрытий медь используется редко, так как быстро окисляется под действием кислорода воздуха и как следствие – тускнеет.
Превосходные выравнивающие и кроющие свойства меди делают ее идеальной для использования в качестве подложки перед нанесением других металлов. Помимо этого, благодаря своей мягкости и пластичности, медь легко полируется до яркого блеска, что позволяет получать на ней такой же яркий и блестящий слой другого металла.
Медь способна заполнять остроугольные углубления и сглаживать нежелательные неровности поверхности, позволяя наносить основной металл гладким равномерным слоем. Выравнивающие и кроющие свойства меди дают возможность избежать образования пор и пузырьков на конечном покрытии.
В качестве металлической подложки медь может наноситься на алюминий, который из-за наличия окисной пленки практически не удерживает покрытия других металлов, осаждаемых электролитическим способом. Медь – единственный металл, который можно осаждать на поверхность изделий из цинка, свинца, медно-свинцовых и цинковых сплавов, отлитых под давлением.
Меднение в кислых электролитах.
В кислых электролитах медь присутствует в виде двухвалентных ионов. Чаще всего используются сульфатные и фторборатные электролиты так как они устойчивы в эксплуатации и не токсичны, имеют высокий выход по току (95-100%) и высокую скорость осаждения. Электролиты обладают хорошей выравнивающей способностью, особенно в присутствии органических добавок – производных пиридина, гидразина, некоторых красителей.
При использовании кислых электролитов не удается получить прочно сцепленных медных осадков непосредственно на стальных изделиях из-за контактного выделения меди. Однако при введении в такие электролиты органических добавок, тормозящих процесс контактного обмена, можно получить осадки, прочно сцепленные со сталью. В промышленности перед меднением стальных изделий в кислых электролитах на них наносят подслой никеля толщиной 0,3 – 0,5 мкм.
Состав сульфатных электролитов и режим осаждения:
| Состав электролита (г/л) и режим осаждения |
Электролит №1 | Электролит №2 | Электролит №3 |
| Сульфат меди | 200-250 | 200-250 | 180-250 |
| Хлорид натрия | – | 0,06-0,09 | – |
| Серная кислота | 50-70 | 40-60 | 30-50 |
| Соляная кислота | – | – | 0,01-0,02 |
| Блокообразующая добавка | – | Зависит от добавки. | – |
| Температура, 0С | 18-25 | 18-25 | 18-25 |
| Катодная плотность тока, А/дм2 | 1-2 | 3-5 | 2-3 |
Состав фторборатных электролитов и режим осаждения:
| Состав электролита, г/л | Электролти №4 | Электролит №5 |
| Фторборат меди | 35-40 | 220-250 |
| Кислота борфтористоводородная свободная | 15-18 | 2-3 |
| Кислота борная | 15-20 | 15-16 |
| Температура, 0С | 18-25 | 60 |
| Катодная плотность тока, А/дм2 | До 10 | До 30 |
Электролит №1 – стандартный сернокислый, при перемешивании сжатым воздухом или механическим способом катодную плотность тока можно поднять до 6-8 А/дм2. Качество и мелкозернистость осадков, получаемых из этого электролита, повышаются при введении 7-10 мл/л этилового спирта.
Электролит №2 – используется для осаждения блестящих медных покрытий, обладает выравнивающим действием, требует высокой чистоты компонентов.
Электролит №3 – применяется для осаждения блестящих покрытий на детали несложной конфигурации.
Электролиты №4, 5 – фторборатные, используются для осаждения толстых слоев меди. Перемешивание, как правило, производят сжатым воздухом или механической мешалкой.
Меднение в щелочных электролитах.
Составы цианидных электролитов и режимы осаждения:
| Состав электролита (г/л) и режим работы |
Электролит №1 | Электролит №2 | Электролит №3 | Электролит №4 |
| Цианид меди | 40-50 | 25-30 | 25-30 | 100-120 |
| Цианид натрия | 45-55 | 55-70 | 35-40 | 135 |
| Карбонат натрия | 10-15 | – | 20-30 | – |
| Едкий натр | 3-5 | 4-5 | До pH = 12,5 | 25-30 |
| Тартрат калий-натрия | – | – | 45-50 | – |
| Роданид натрия | – | – | – | 15-20 |
| Температура, 0С | 40-45 | 18-25 | 55-70 | 70-80 |
| Катодная плотность тока, А/дм2 | До 1,5 | 0,3-0,6 | 1,5-6,0 | 1,0-4,0 |
Электролит № 1 – один из самых распространенных в промышленности.
Электролит № 2 – применяется для предварительного меднения стальных изделий.
Электролиты № 3,4 – высокопроизводительные цианистые электролиты меднения.
Во всех цианистых электролитах отношение анодной поверхности к катодной рекомендуется поддерживать равным 2:1. Применение реверсивного тока при использовании цианистых электролитов приводит к увеличению блеска и понижению пористости покрытий.
Основное достоинство цианистых электролитов меднения – высокая рассеивающая способность, мелкозернистость осадков и возможность непосредственно осаждать медь на стальные изделия. Главные недостатки – токсичность, невысокая устойчивость, низкий выход по току, малая скорость осаждения.
Из нецианистых щелочных электролитов меднения наибольшее распространение получили пирофосфатные электролиты.
Составы пирофосфатных электролитов и режимы работы:
| Состав электролита (г/л) и режим работы |
Электролит №1 | Электролит №2 | Электролит №3 | Электролит №4 |
| Сульфат меди | 30-50 | 80-90 | 1.0-2.5 | 45-55 |
| Пирофосфат натрия | 120-180 | – | – | 200-240 |
| Гидрофосфат натрия | 70-100 | – | – | – |
| Пирофосфат калия | – | 350-370 | 80-120 | – |
| Нитрат аммония | – | 20-25 | – | – |
| pH | 7,5-8,9 | 8,5 | – | 7-8 |
| Температура, 0С | 20-30 | 50-55 | 18-25 | 55-65 |
| Катодная плотность тока, А/дм2 | 0,3-0,4 | 0,5 | 1-3 | 0,3-0,8 |
Электролит № 1 – наиболее часто применяемый в промышленности, требует при работе отношения катодной площади к анодной, равного 1:3. При нанесении покрытий на сталь, детали следует опускать в электролит под током, кроме того, в начале электролиза следует дать «толчок тока» в течении 20-50 секунд.
Электролит № 2 – применяется для меднения стали и цинковых сплавов.
Электролит № 3 – применяется для предварительного меднения алюминиевых сплавов.
Электролит № 4 – применяется для непосредственного меднения алюминиевых сплавов.
По рассеивающей способности пирофосфатные электролиты не уступают цианистым. Микротвердость и внутренние напряжения осадков, полученных в этих электролитах, существенно не отличаются от тех, что получены в цианистых.
Недостатки пирофосфатных электролитов – неустойчивость и недостаточная адгезия получаемых из них покрытий со сталью. Чаще всего применяются для нанесения меди на алюминиевые сплавы, а также при металлизации диэлектриков.
Покрытия меди и ее сплавов
Как уже было сказано, на поверхность меди и ее сплавов можно наносить разнообразные антикоррозийные и декоративные пленки (металлические и неметаллические), а также покрытия, которые предохраняют медные детали, работающие в подвижных сочленениях, от преждевременного истирания.
Хромирование. Хромовые покрытия, кроме высоких декоративных качеств, стойки в химическом отношении и обладают большой механической прочностью. Поэтому часто хромируют трущиеся детали, что значительна увеличивает их долговечность.
Детали, предназначенные для хромирования, тщательно зачищают шкуркой, а если необходима блестящая поверхность, то полируют до зеркального блеска,
Примечание. Хорошо очищает медь и ее сплавы кашица и;
мелкой поваренной соли с уксусом.
• После зачистки деталь обезжиривают одним из со-стявов:
| Температура смеси 90° С, время обезжиривания 1 час. |
,-я смесь: известь гашеная — 35 г/л;
едкий калий — 10 г/л;
жидкое стекло — 3 г/л.
| 2-я смесь:едкий натр (калий) — 75 г/л; жидкое стекло — 20 г/л. 3-я смесь: известь свежегашеная — 350 г/л. |
| Температура смеси 90° С, время обезжиривания 1 час, |
Третьей смесью деталь тщательно протирают несколько раз.
За обезжириванием следуют промывка в теплой
воде и декапирование в течение 1 мин в 5% растворе серной кислоты. Для этого готовят электролитическую ванну (в эмалированной или стеклянной посуде) следующего состава:
хромовый ангидрид — 400 г/л;
серная кислота (концентрированная) — 4 г/л.
Температура раствора в ванне должна поддерживаться около 60° С.
Анодом (+) в ванне служат несколько свинцовых
пластин (не менее двух), расположенных вокруг хроми

руемой детали. Общая площадь сторон пластин, обращенных к детали, должна быть в 1,5—2 раза больше площади поверхности детали. Деталь служит катодом (—), при этом катодная плотность тока должна быть 8—10 а на каждый квадратный дециметр хромируемой поверхности при напряжении источника постоянного тока 6—9 в (рис, 4). Скорость нарастания слоя хрома 5 мк/час.
По окончаний хромирований Деталь извлекают из электролитической ванны, тщательно промывают водой и протирают сухой ветошью. При необходимости деталь
Никелирование. Покрытие медных, латунных и бронзовых деталей никелем создает на поверхности детали красивую, блестящую пленку, служащую одновременно
и антикоррозийным покрытием.
Химическое никелирование дает плотную блестящую пленку. Эта пленка^более устойчива ко всем видам воздействия, чем полученная электролитическим никелированием.
Химическое никелирование не требует сложного оборудования и особых затрат на материалы.
Деталь зачищают и, если надо, полируют. Затем обезжиривают в одной из смесей, применяемых при хромировании. Декапирования при этом производить не
После этого готовят раствор для никелирования. В эмалированную посуду наливают произвольное количество 10% растворахлористого цинка («паяльная кислота») и к нему добавляют сернокислый никель до тех пор, пока весь раствор не станет густого зеленого цвета. Полученный раствор нагревают до кипения и в него опускают деталь. В кипящем растворе деталь должна находиться 1—2 час (при этом толщина слоя никеля на детали будет около 5—10 лмс), затем деталь переносят в меловую воду (10—15 г мела на стакан воды) нелегка протирают ветошью. После этого деталь промывают и протирают насухо.
Примечания: 1. Раствор можно использовать еще раз, но хранить его нужно в плотно закупоренной посуде (срок хранения
2. Никель хорошо ложится и внутри трубок при принудительной
подаче раствора внутрь трубки.
Серебрение. Есть несколько способов серебрения меди и ее сплавов.
Рассмотрим три из них.
1-й способ. Несколько листов матовой фотобумаги «Унибром» разрезают на куски и опускают в раствор фиксажной соли (соль разводят в объеме воды, указанном на упаковке).
Зачищенную и обезжиренную деталь помещают в этот раствор и натирают эмульсионным слоем бумаги до тех пор, пока на поверхности детали не образуется плотный слой серебра. После промывки в теплой воде деталь протирают сухой ветошью.
2-й способ. В 300 мл отработанного фиксажа (оставшегося после печатания фотографий”) добавляют 1—2 мл нашатырного спирта и 2—3 каплиформалина(раствор хранить и работать с ним только в темноте).
Зачищенную и обезжиренную деталь поместить в раствор на 0,5—1,5 час, промыть в теплой воде, высушить и протереть мягкой ветошью.
3-й способ. Приготовить пасту: в 300 мл воды растворить 2 газотнокислого серебра (ляписа). К раствору подливать 10% раствор поваренной соли до тех пор, пока не прекратится выпадение осадка хлористого серебра. Этот осадок промыть несколько раз (5—6) в
Отдельно в 100 мл воды растворить 20 г гипосульфита (фотореактив) и 2 г хлористого аммония. Затем в образовавшийся раствор небольшими дозами добав’-пять хлористое серебро до тех пор, пока оно не прекратит растворяться.
Полученный раствор отфильтровать и смешать с тонко размельченным мелом до консистенции густой
Подготовленную деталь (зачищенную и обезжиренную) натирают пастой до образования плотного слоя серебра на поверхности детали. Затем деталь промывают теплой водой и протирают сухой ветошью.
Примечания: 1. При серебрении необходимо пользоваться дистиллированной водой (можно снеговой, дождевой или полученной изо льда бытовых холодильников), иначе могут получиться некрасивые серые пятна на поверхности посеребренной детали.
2. Посеребренные детали не должны соприкасаться с деталями из резины и эбонита, которые содержат серу. При контакте с такой резиной или эбонитом на поверхности серебра образуется пленка сернистого серебра, увеличивающая переходное сопротивление контактов и ухудшающая декоративность покрытия.
Химическое окрашивание латуни. Химическое окрашивание применяют как декоративное покрытие.
Можно получить оригинальные цвета латуни, если обработанную деталь (зачищенную, обезжиренную и
промытую) поместить в один на следующих растворов.
| 1-й раствор: гипосульфит—11 г/л; свинцовый сахар — 39 з/л. |
| Температура раствора 70° С. |
2-й раствор. В 250 мл кипящей воды последовательно растворяют 10 гедкого натра и 10 г молочного сахара. Затем, непрерывно помешивая, подливают к раствору 10 мл концентрированного раствора медного купороса.
Обработанную деталь помещают в один из растворов, и в течение 3—10 мин деталь окрашивается в золотистый, голубоватый, синий, фиолетовый и, наконец,
в радужный цвет.
Когда нужный цвет получен, деталь вынимают, сушат и полируют суконкой.
Синевато-черный цвет латуни получается при погружении подготовленной детали на 1—3 мин в следую-ищи раствор:
аммиак (25% нашатырный спирт) —500 г;
двууглекислая (или углекислая) медь — 60 г;
латунь (опилки) — 0,5 г.
После смешения компонентов раствор энергично взбалтывают 2—3 раза, после чего в него погружают
Коричневый цвет латуни получается при погружении, детали в один из следующих растворов.

Чтобы приготовить 3-й раствор, нужно оба вещества растворить отдельно в половинном объеме воды, затем слить их вместе и нагреть до 80—90° С.
Примечание. После окрашиваний Де+аЛь йромыаают теплой водой, сушат и покрывают бесцветным лаком.
Химическое окрашивание меди, латуни и бронзы осуществляется так же, как и химическое окрашивание стали (применяются те же растворы, образуются те же
Пассивирование латуни. При пассивировании латуни
образуется устойчивая защитная пленка, похожая на позолоту. Эта пленка не боится влаги, поэтому рыболовы пассивируют латунные блесны.
Подготовленную деталь (зачищенную, отполированную и обезжиренную) опускают на 1 сек в раствор, приготовленный из одной частиазотной и одной части серной кислоты. После этого деталь сразу же переносят в крепкий раствор двухромовокислого калия (хромпика) на 10—15 мин. Затем деталь промывают и сушат.
Травление меди и ее сплавов. При изготовлении шильдиков, надписей на меди и ее сплавах пользуются
Поверхность детали заливают горячим парафином
(асфальтовым или асфальтобитумным лаком). Штихелем (или другим острым инструментом) делают нужную надпись (необходимо, чтобы в этих местах защитная пленка парафина была удалена до металла). Подготовленную таким образом деталь заливают одним из приведенных ниже составов.
1-й состав:азотная кислота — 75 в. ч.;
 |
fonuao КИСЛОТа ‘ (г ” ” ‘
С протравленной детали удаляют парафин и валиком или стеклом наносят краску.
Снятие покрытий с меди и ее сплавов. При снятии старых или неудачно получившихся покрытий с меди
или ее сплавов необходимо пользоваться растворами,
указанными в табл. 10.

 studopedia.org – Студопедия.Орг – 2014-2021 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.005 с) .
studopedia.org – Студопедия.Орг – 2014-2021 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.005 с) .
Защита меди от коррозии – лучшие методы
 Как быстро ржавеет медь и что с этим делать
Как быстро ржавеет медь и что с этим делать
Медные изделия применяются людьми на протяжении многих веков. Даже в древнейшие времена стоимость такого металла могла приравниваться к стоимости золота, так как производства данного металла было очень дорогостоящим.
На данный момент медь стала куда дешевле, и потому из нее, помимо украшений, стараются делать посуду, аксессуары в интерьер и остальные предметы. Не задумывались ли над тем, как быстро ржавеет медь?
Коррозия меди, в отличия от того же железа, развивается крайне медленно за счет ее устойчивости к такому явлению, и все же иногда требуется принимать меры по очищению изделий от ужасного налета.
Коррозия металлов/сплавов – что это
Под ржавлением подразумевается процесс разрушения металла под воздействием негативных факторов в окружающей среде. В той или иной мере будут ржаветь все металлы, сплавы, и в результате этого на них появляется ржавчина и места ухудшения целостности (а именно, дыры). Со временем могут начать портиться все неметаллы – примером можно называть старение резины или даже пластика от воздействия с кислородом, при постоянном контакте с водой, а еще из-за температурных перепадов.
Главной первопричиной ржавления можно считать термодинамическую неустойчивость металла к воздействию факторов физического типа или даже веществ химического происхождения, которые есть в контактной среде. В сравнении с железом медь будет окисляться куда меньше, но при увеличении температуры такой процесс будет сильно ускоряться. При регулярном нахождении в среде при температуре выше +105 градусов любой металл будет ржаветь в несколько раз быстрее.
Подробности
Коррозионные качества
Медь представляет собой металл с высокими свойствами пластичности, которые имеют красновато-золотистый цвет, а после снятия оксидной пленки немного розоватым. По электрической проводимости он будет уступать только серебру, еще характеризуется огромной степенью тепловой проводимости. За счет низкого удельного сопротивления медь используется в электротехнике – она идет на изготовление пластинок из меди, обмотки электрической двигателей, проволоки.
Обратите внимание, что из-за прекрасных антикоррозионных свойств металл будет включаться в сплавы для усовершенствования их инженерных характеристик (латунь, бронза и прочие). В гальванической среде медь превращается в катод, и начинает вступать в электрохимические процессы, а еще вызывает ускоренный процесс ржавления остальных металлов.
Медь является неактивным химическим элементов, и потому она практически не взаимодействует с водой (морской или пресной), воздухом. Если воздух сухой, на поверхность материала будет формироваться оксидная пленка с толщиной до 50 мн. Изделие из меди начинает темнеть, становится зеленоватым или коричневым, и это называется патиной. Во множестве случаев патина воспринимается, как покрытие декоративного типа. Коррозионная интенсивность мала при контактировании с разведенной соляной кислотой, но при реакции со множеством остальных кислот, с галогенами, «царской водкой» металл будет окислен с образованием медного карбоната.
Условия для разрушения меди
Несмотря на стойкости к порче, даже изделия из меди при определенных условиях способны ржаветь. Меньше всего такие явления выражены в воде, влажном воздухе, почве и даже больше – в среде кислого типа. Ощутимо уменьшать коррозию можно посредством лужения – покрытия меди оловянным слоем. Качественный процесс лужения дает надежность и защиту от дефектов, а еще повышает устойчивость к коррозии, делает материал не подверженным воздействию высокой температуры, града, дождя и снега. Срок применения луженых изделий будет составлять больше сотни лет без потери первозданных качеств.
Воздействие воды
 Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Защита меди от коррозии очень важна. Скорость ржавления меди в воде будет сильно зависеть от наличия пленки оксидного типа на ее поверхности, а также от уровня насыщенности воды посредством кислорода. Чем больше кислорода в воде, тем интенсивнее будет протекать разрушение материала. В целом же, медь можно считать устойчивой к вредоносному воздействию пресной и соленой воды, и негативно воздействуют на нее лишь растворенные хлорные ионы, а еще низкая степень рН. Прочность, а также неподверженность ржавлению дает возможность применять материалы для изготовления трубопровода.
Обратите внимание, что, если на поверхности изделия, которое покрыто посредством меди, имеет зеленая или даже коричневая оксидная корочка, разрушающие компоненты в малой степени будут проникать внутрь. Как правило, слой оксида образуется спустя 2 месяца нахождения металла в воде. Намного прочнее будет считаться зеленая корочка (то есть карбонатная), рыхлой и не такой крепкой – черная (сульфатная).
В воде из моря степень коррозии почти такой же, как и в обычной, то есть пресной. Лишь при ускорении передвижения воды ржавление станет ударным, и потому более интенсивным. Медь является материалом, который не может обрастать морскими микроскопическими организмами, потому что его ионы губительные для водорослей и моллюсков. Такое свойство металла применяется в судоходстве, а также в рыбном хозяйстве.
Влияние щелочей и кислот
В щелочах медь не будет портиться, потому что материал сам по себе является щелочным, зато кислоты для нее будут являться самыми негативными по воздействию. Самая быстрая и значимая коррозия будет происходить при контактировании с серой и ее кислотными типами соединений, а азотная кислота способна полностью разрушать структуру материала. В концентрированной кислоте медь начинает растворяться, и потому при изготовлении оборудования для промышленности нефтегазового типа требуется дополнительная защита.
С такой целью применяют ингибиторы – замедлители химической реакции:
- Экранирующие – создают пленку, которая не дает кислотам достигать медной поверхности.
- Окислительные – помогают превратить верхний слой в окись, которая начнет вступать в реакцию с кислотами без вреда непосредственно для самого металла.
- Катодные – увеличивают катодное перенапряжение, чем замедлят реакцию.
Рассмотрим еще кое-что, касающееся коррозии
Коррозия от влажного воздуха и почвы
В почве проживает большое количество микроскопических организмов, которые способны вырабатывать сероводород, так как среда тут кислая, а скорость коррозии меди возрастет. Чем больше отклонение значения рН в стороне окисления, тем скорее будут протекать разрушительные процессы. Если почва оснащена кислородом, то металл начинает окисляться, но ржаветь будет меньше. При длительном нахождении изделий из меди в земле они начинают зеленеть, становятся рыхлыми и способны даже рассыпаться. Краткосрочное пребывание в грунте вызывает образование патины, от которой предмет можно очищать. Кстати, влажный воздух способен плохо сказываться на состоянии материала лишь при длительном контакте, а для начала тоже вызывает образование патины (оксидного слоя). Исключение будет составлять пар, который насыщенный сульфидами, хлоридами, углекислотой – в нем коррозия будет развиваться стремительнее.
Почему медные изделия требуется регулярно очищать?
Ковши из меди, турки, самовары отличаются высокой степенью тепловой проводимости, и потому нагревание в них протекает равномерно, а продукты будут приготовлены быстрее. Это обусловлено высокую популярность изделий в быту. Потребность в очистке медных предметов обусловлено утратой ими визуальной привлекательности спустя время. Особенно быстро начинают тускнеть и теряют естественный цвет изделия, которые находятся на воздухе или даже часто нагревающиеся.
Коррозия меди в виде оксидной пленки (патины) популярна лишь в тот момент, где требуется придание предметам винтажного облика, стилизация под старину. В обратном случае она будет портиться внешний вид посуды, утвари, а также статуэток и украшений. Чтобы устранять оксидный налет, элементы потемнения и вернуть прежний блеск, требуется время от времени чистить предметы. Также очищение требуется для того, чтобы исключить попадания в пищу вредоносных соединений, которые способы присутствовать в зеленом и черном слое.
Эффективные способы очистки меди
Произвести очищение медных предметов несложно, для этого не требуются дорогостоящие средства. Вот наиболее популярные методики, которые используют в домашних условиях:
 Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.
Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.- Раствор для мытья посуды – следует намылить хозяйственную губку простым средством для посуды, тщательно протирайте поверхность и смывайте водой. такой метод лучше всего подойдет для изделий, которые лишь слегка потускнели.
- Лимон – следует натереть медную поверхность лимонной долькой, а после пройдитесь по нему щеточкой с жесткими ворсинками и помойте водой.
- Мука и уксус – влейте в чашку малое количество, добавьте муки до получения теста со средней густотой. Смажьте медное изделие посредством теста, оставьте до просыхания, а после удалите остатки. После остается натереть изделия мягкой тряпкой.
- Соль и уксус – налейте в кастрюльку из нержавеющей стали уксус 9%, всыпьте немного соли и доведите до кипения. Огонь следует выключить, закинуть в раствор предмет из меди, не убирать его до остывания жидкости. Данный способ подойдет для очень загрязненных поверхностей.
А теперь рассмотрим, как чистить медные монеты.
Очистка медных монет
Именно монетки из меди представляют собой антиквариат, и в наше время не будут выпускаться. Нередко требуется их очищать, чтобы вернуть красивый внешний вид. Если монета из меди контактировала со свинцом, налет на ней бывает желтоватым. В этом случае он будет прекрасно очищаться посредством столового уксуса (9%). Зеленый налет следует убрать посредством раствора лимонной кислоты (10%) или даже лимонным натуральным соком, коричневый аммиаком или углекислым аммонием.
Следует помнить о том, что иногда слой патины помогает придавать монетам более винтажный и благородный внешний вид, и потому удалять его стоит не всегда. Некоторые де стараются искусственно состарить деньги домашним методом. Для этого возьмите литр дистиллированной воды, 5 грамм марганцовки (аптечной) и 50 грамм медного купороса. Раствор следует нагреть, не доводя до кипения, бросить в него монеты, оставить до получения требуемого оттенка. Для закрепления полученного эффекта просохшие деньги обработайте все смесью спирта и бензола (1 к 1). После монеты обретают красивый состаренный вид и способны украшать любые коллекции антикварных предметов.
Коррозия меди: причины ржавления и способы защиты
Коррозия меди — это процесс спонтанного разрушения данного металла в результате различных видов воздействия окружающей среды. Здесь нельзя применить такое понятие, как ржавление, которое привычно для описания данного процесса с железом. Причиной коррозии любых металлов служит термодинамическая неустойчивость материала к воздействию активных веществ, находящихся в воздухе. Скорость коррозии меди напрямую зависит от изменения температуры. При увеличении температуры на 100 °С темпы протекания реакции возрастают в несколько раз.
Свойства меди
Медь — это переходный элемент с ярко выраженными пластическими свойствами. Имеет золотистый цвет, а при отсутствии оксидной пленки — с добавлением розового. Это первый металл, который начал использовать человек. Латинское наименование элемента Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где в древности медь добывалась. Второе название — Aes, в переводе с латыни означает «руда» или «рудник».

- На воздухе металл покрывается оксидной пленкой, которая придает ему отличительный красно-желтый цвет. Медь вместе с золотом, осмием и цезием имеет преимущественно яркую окраску, что отличает их от других металлов, имеющих серебристый или серый цвет. Этот металл имеет высокую теплопроводность, а по электропроводности уступает только серебру.
- Медь характеризуется высокими коррозионными качествами и не реагирует с водой и разбавленной соляной кислотой. Окисляется «царской водкой», галогенами, кислородом. На воздухе с повышенным содержанием влаги металл окисляется и образует карбонат меди, который составляет верхний слой патины. Процесс образования защитной оксидной пленки на открытом воздухе длителен и может продолжаться несколько лет. В результате этого поверхность металла темнеет и приобретает коричневатый оттенок. После образования пленки на металле появляются соли меди, имеющие зеленоватую окраску. Оксид меди и соли называется патиной. Цвет ее изменяется от коричневатого до зеленого и черного и зависит от многих внешних факторов. Патина нейтральна к меди и наделена защитными и декоративными свойствами.
- Имея низкое удельное сопротивление, этот металл широко используется в электротехнике. Из него делают проволоку, идущую на изготовление обмоток электродвигателей. Листовой материал идет на изготовление различных элементов электрических аппаратов. Наличие в составе металла даже небольшого количества примесей значительно снижает его электропроводность.
- Медь используется для производства сплавов. На ее основе изготовляются латунь, бронза, дюралюминий и др. Благодаря высоким антикоррозионным характеристикам они широко используются для плакировки металлов с целью уменьшения коррозионного износа.
Коррозионные свойства
Поскольку материал не является химически активным элементом, коррозия меди практически не происходит при взаимодействии с воздухом, пресной и морской водой.
В сухом воздухе образуется тонкая оксидная пленка, толщина которой составляет около 50 нм. В пресной воде скорость коррозии металла составляет 0,05–0,25 мм/год. Однако при содержании в жидкости аммиака, сероводорода, хлоридов и некоторых других примесей интенсивность коррозионного процесса возрастает.
В морской воде коррозия меди незначительна, и интенсивность ее соизмерима с разрушением в пресной. Однако при увеличении скорости движения среды возникает ударная коррозия, что приводит к повышению скорости процесса. Коррозия меди существенно зависит от температуры, и при возрастании последней скорость разрушения увеличивается.
Медь является единственным материалом, который не подвержен обрастанию водорослями, так как ее ионы губительно действуют на них. В почве, насыщенной микроорганизмами, скорость коррозионных процессов заметно возрастает. Интенсивность их протекания напрямую зависит от pH грунта. Чем больше отклонение значения показателя от нейтрального, тем быстрее происходит коррозия металла. Влияние микроорганизмов на процесс разрушения обуславливается выделением сероводорода в результате их жизнедеятельности.
Продукты почвенной коррозии элемента отличаются от атмосферной, имеют более сложный состав и структуру.
При очень длительном нахождении медных предметов в почве они превращаются в рыхлую массу светло-зеленого цвета, при непродолжительном — покрываются незначительным слоем патины, которая легко удаляется при очистке.
Коррозия меди, покрытой слоем олова (луженой), практически отсутствует. При качественном лужении она прекрасно служит под воздействием града и снега, становится нечувствительной к перепаду температур. Срок службы таких материалов составляет около 100 лет. При этом не теряются первоначальные свойства. Со временем цвет не изменяется, а остается первоначальным — серебристо-металлическим. Луженая медь прекрасно показала себя в качестве кровельного материала. Ведь не зря купола многих храмов покрывают именно этим материалом.

Из-за высокой коррозионной устойчивости к воздействию многих агрессивных сред медь нашла широкое применение в химической промышленности.

В гальванической паре она является катодом для большинства металлов и сплавов и в результате электрохимических процессов при контакте с ними вызывает их ускоренную коррозию.
Эффективные методы очистки меди
Провести чистку медных предметов несложно, для этого не понадобятся дорогостоящие средства. Вот самые популярные методики, применяемые в домашних условиях:
- Кетчуп. Взять немного томатного кетчупа, смазать им изделие, оставить на две минуты. После ополоснуть струей воды.
- Раствор для мытья посуды. Намылить хозяйственную губку обычным средством для посуды, тщательно протереть поверхность, смыть водой. Этот способ лучше всего подходит для изделий, которые лишь немного потускнели.
- Лимон. Натереть медную поверхность долькой лимона, после пройтись по ней щеткой с жесткими ворсинками и помыть водой.
- Уксус и мука. Влить в чашку немного уксуса, добавить муку до получения теста средней густоты. Смазать медь тестом, оставить до высыхания, потом удалить остатки, а изделие натереть мягкой тряпочкой.
- Уксус и соль. Налить в кастрюлю из нержавеющей стали уксус 9%!, всыпать немного соли, дать закипеть. Огонь выключить, в раствор положить медный предмет, не убирать его до остывания жидкости. Этот способ подходит для сильно загрязненных поверхностей.
Защищаем изделия из меди
Для сохранения красноватого оттенка изделия из красной меди необходимо покрыть его специальным лаком, чтобы избежать окисления.
На воздухе медь сначала становится коричневой, а затем образуется ее зеленоватая окись, которую необходимо растворить, поскольку эта патина консервирует скрывающуюся под ней медь.
В настоящее время, в связи с появлением новых источников загрязнения окружающей среды, в воздухе все больше появляется растворимых солей меди. Они выпадают вместе с осадками и загрязняют фасады зданий. Для предотвращения этого имеются различные консервирующие составы, которые наносятся на хорошо очищенную поверхность изделия.
Для очистки медного изделия лучше всего использовать 10%!й спиртовой раствор соляной кислоты. Он наносится на поверхность меди, затем его нужно основательно располировать сукном до полного блеска, после чего изделие промывают чистой водой.
Внимание! Соляная кислота очень едкая, поэтому берегите глаза, работайте в защитных очках и резиновых перчатках. Наливайте раствор только в кислотоупорный сосуд -обычные металлические сосуды кислота разъедает. Остатки неиспользованного раствора необходимо выбросить в специальный мусоросборник. После того как медь просохнет, ее можно покрыть защитным слоем. Рекомендуем для этой цели двухкомпонентный акриловый лак, который используется для покраски автомобилей. Этот лак бесцветен и отлично ложится на медь (правда, он сравнительно дорог). В зависимости от вида лак разводится в пропорции 2:1 или 3:1 плюс 10-15%!разбавителя.
Двухкомпонентные ак-риловые лаки быстро сохнут. Если использовать «замедленный» отвердитель, процесс высыхания можно растянуть. Менее стойки однокомпонентные акриловые лаки. Для изделий, находящихся во внутренних помещениях, можно использовать комбинированный нитролак (например, «Zapon-лак»). Популярный алкидный лак (так называемый лак на искусственных смолах) непригоден для этой цели, так как, соединяясь с медью, он дает соль зеленого цвета. Прочность лакового покрытия во многом зависит от толщины защитного слоя. По этому надо наносить как минимум три слоя с промежутком в один день.

1. Медь обладает свойством изменять цвет. При появлении зеленых пятен патины необходимо очистить изделие и покрыть его защитным лаком. Только в этом случае возможно сохранить естественный цвет меди.

2. Очистить поверхность медного изделия 10%!м спиртовым раствором соляной кислоты. Работать только в резиновых перчатках.

3. Отполировать поверхность до металлического блеска тряпкой из искусственного волокна. Промыть водой и дать просохнуть.

4. Для консервации покрыть поверхность медного изделия двухкомпонентным бесцветным акриловым лаком.
Инструменты:
Губка, полировальная тряпка, кисть, валик или разбрызгиватель (пистолет), защитные очки и перчатки.
Коррозия меди
Коррозия меди – это ее разрушение под воздействием окружающей среды.
Медь и ее сплавы нашли широкое применение во многих отраслях промышленности. Это связано с высокой коррозионной стойкостью данного металла, теплопроводностью, электропроводностью. Медь отлично обрабатывается механически, паяется.
Значительная коррозия меди наблюдается в окислительных кислотах, аэрированных растворах, которые содержат NH 4+ , CN — и другие ионы, способные с медью образовывать комплексы.
Коррозия меди в воде
Скорость коррозии меди в воде во многом зависит от наличия на поверхности оксидных пленок.
В быстро движущихся водных растворах и воде медь подвергается такому виду разрушения, как ударная коррозия. Скорость протекания ударной коррозии меди сильно зависит от количества растворенного кислорода. Если вода сильно аэрирована – ударная коррозия меди протекает интенсивно, если же обескислорожена – разрушение незначительно. Коррозия меди в аэрированной воде усиливается с уменьшением рН, увеличением концентрации ионов хлора. Скорость коррозии меди в воде зависит от климатической зоны. В тропиках скорость разрушения несколько выше.
Особенностью меди, омываемой морской водой, можно считать то, что она является одним из немногих металлов, которые не подвержены обрастанию микроорганизмами. Ионы меди для них губительны.
С чистой меди очень часто изготавливают трубопроводы для подачи в дома воды. Они надежны, служат очень долгое время. При наличии в воде растворенной угольной и других кислот медь понемногу корродирует, а продукты коррозии меди окрашивают сантехническое оборудование. Если вода, проходящая через медные трубы контактирует с железом, алюминием или оцинкованной сталью – то коррозию этих металлов значительно усиливается. Ионы меди осаждаются на поверхности этих металлов, образуя коррозионные гальванические элементы.
Чтоб исключить вредное влияние воды с медных труб на другие металлы используют луженую медь. Внутреннюю часть медного трубопровода покрывают оловом. Оловянное покрытие должно быть безпористым, во избежание возникновения гальванического элемента (олово по отношению к меди является катодом).
Коррозия луженой меди
Луженая медь отличается превосходной коррозионной стойкостью. Луженая медь отлично служит даже под воздействием дождя, града, снега, не чувствительна к перепаду температуры окружающей среды. Атмосферная коррозия луженой меди весьма незначительна. Оловянное покрытие по отношению к меди является анодом, т.к. имеет более электроотрицательный потенциал. Если на нем нет никаких изъянов (пор, трещин, царапин), через которые медь контактирует с атмосферой – оно прослужит очень долго. Если же дефекты покрытия присутствуют – атмосферная коррозия луженой меди протекает по следующим реакциям:
А: Sn — 2e→ Sn 2+ — окисление олова;
К: 2 H2О + O2 + 4e → 4 OH — — восстановление меди.
Качественное оловянное покрытие продлевает срок службы луженой меди до 100 лет и более.
Атмосферная коррозия меди
В атмосферных условиях медь отличается высокой коррозионной стойкостью. На сухом воздухе поверхность меди почти не меняется. А при контакте с влажным воздухом образуется нерастворимая пленка, состоящая с продуктов коррозии меди типа CuCO3•Cu(OH)2.
В зависимости от состава среды и еще многих факторов на медной поверхности в атмосфере сначала образуется очень тонкая защитная пленка, состоящая с оксидов меди и ее чистой закиси. Время образования этой пленки может достигать нескольких лет. Поверхность немного темнеет, становится коричневатой. Иногда пленка может быть почти черного цвета (во многом зависит от состава коррозионной среды). После образования оксидного слоя на поверхности начинают скапливаться соли меди, имеющие зеленоватый оттенок. Образующийся оксид меди и соли называют еще патиной. Цвет патины колеблется от светло коричневого, до черного и зеленого. Зависит от качества обработки поверхности, состава самого металла и среды, времени контакта с коррозионной средой (от внутренних и внешних факторов). Закись меди – красно-коричневого цвета, окись – черного. Голубые, зеленые, синие и другие оттенки патины обуславливаются различными медными минералами (сульфаты, карбонаты, хлориды и др.). Патина по отношению к основному металлу нейтральна, т.е. не оказывает на медь вредного влияния (кроме хлористой меди). Соли и оксиды, формирующие патину, нерастворимы в воде и обладают естественными декоративными, защитными свойствами по отношению к поверхности меди.
Присутствие во влажном воздухе углекислого газа приводит к образованию на поверхности смеси, которую еще называют малахитом. Сульфиды, хлориды, находящиеся в воздухе, разрушают малахит. Это ускоряет атмосферную коррозию меди.
Коррозия меди в почве
Коррозия меди в почве сильно зависит от значения рН грунта. Чем грунт щелочнее либо кислее, тем быстрее проходит коррозия меди в почве. Менее сильное влияние оказывает аэрация, влажность грунта. При сильном насыщении почвы микроорганизмами усиливается коррозия меди и ее сплавов. Это объясняется тем, что некоторые из них в процессе своей жизнедеятельности вырабатывают сероводород, который разрушает защитную оксидную пленку.
Продукты почвенной коррозии меди и ее сплавов по составу более сложны, чем при атмосферной коррозии и отличаются слоистой структурой.
Если медное изделие пролежало в почве очень долгое время – оно могло полностью превратиться в рыхлую светло-зеленую массу, состоящую с продуктов коррозии меди. При недолгом нахождении изделия в почве может наблюдаться только небольшой слой патины, который легко снять механически.
Медь устойчива в таких средах:
— горячая и холодная пресная вода;
— в определенных условиях, находясь в контакте с галогенами;
— неокислительных кислотах, горячих и холодных деаэрированных разбавленных растворах H3PO4, H2SO4, уксусной кислоты.
Медь неустойчива в таких средах:
— сера, сероводород, некоторые другие соединения серы;
— окислительные кислоты, аэрированные неокислительные (также угольная), горячий, холодный концентрат H2SO4,
— растворы окислительных солей тяжелых металлов (Fe2(SO4)3, FeCl3);
— аэрированных водах, водных растворах быстро движущихся, агрессивных водах (с низким содержанием ионов магния, кальция, высоким – кислорода, углекислого газа);
— амины, NH4OH (содержащим кислород).
Коррозийные свойства меди
Медь – металл с высокими пластическими свойствами, имеющий красно-золотистый цвет, а после удаления оксидной пленки – чуть розоватый. По электропроводности он уступает лишь серебру, также характеризуется высокой теплопроводностью. Благодаря низкому удельному сопротивлению медь применяется в электротехнике: идет на изготовление медных пластинок, проволоки, обмотки двигателей.
Из-за высоких антикоррозионных качеств металл включается в сплавы для улучшения их технических характеристик (бронза, латунь и другие). В гальванической среде медь становится катодом, вступает в электрохимические процессы и вызывает ускоренное ржавление прочих металлов.
Медь – неактивный химический элемент, поэтому практически не взаимодействует с воздухом, водой (пресной, морской). Если воздух сухой, на поверхности материала формируется оксидная пленка толщиной до 50 мн. Медное изделие темнеет, становится коричневым или зеленоватым, это называется патиной. В ряде случаев патина воспринимается как декоративное покрытие. Интенсивность коррозии низкая при контакте с разбавленной соляной кислотой, но при реакции с рядом иных кислот, с галогенами, «царской водкой» металл окисляется с образованием карбоната меди.

Способы предохранения нержавейки от МКК
Очистить от ржавчины поверхность порой бывает сложно, особенно при глубоком проникновении дефекта. Разработан ряд методов против межкристаллитной коррозии, вот основные из них:
- Отжиг (стабилизирование). Ферритные стали обрабатывают высокими температурами (+750…+900 градусов), за счет чего концентрация хрома на поверхности повышается, при этом распределение элемента становится более равномерным.
- Уменьшение содержания углерода. Если концентрация вещества будет менее 0,03%!, то металл станет практически не подверженным межкристаллитной коррозии.
- Закалка в воде. Этот метод применим для аустенитной стали, он помогает карбидам хрома перейти в более подходящую форму и сконцентрироваться на границах зерен металла.
Чтобы убрать у нержавейки склонность к МКК, в нее вводят и новые добавки: титан, тантал, ниобий, но это приводит к серьезному удорожанию материала. Их количество должно быть в 5-10 раз больше, чем норма углерода, и тогда металл будет не подверженным ржавлению.
Оксидирование меди и ее сплавов
Оксидные покрытия на меди и ее сплавах используются для декоративной отделки изделий. В зависимости от состава сплава и условий оксидирования получаемые пленки окрашены в черный, синий или коричневый цвет. Их защитная способность невелика, поэтому в качестве противокоррозионных покрытии они пригодны только для легких условий эксплуатации. Для повышения защитной способности оксидных пленок их покрывают бесцветным лаком.
Из химических способов оксидирования наибольшее распространение получили персульфатный и медно-аммиачный. Первый из них дает лучшие результаты при обработке меди или медных гальванических покрытий. Образующиеся оксидные пленки имеют черную окраску, по механической прочности и стойкости против коррозии они превосходят пленки, получаемые в медно-аммиачных растворах. В персульфатном растворе не удается достигнуть хорошего качества оксидирования сплавов, содержащих менее 90 % меди. Качество их обработки может быть улучшено, если вести оксидирование в растворах с пониженной концентрацией персульфата или, что более целесообразно, подвергать изделия предварительному меднению.
Медные сплавы с различным содержанием цинка оксидируют в щелочном медно-аммиачном растворе. На сплавах, содержащих 50-65 % меди, получаются пленки черного цвета с синеватым оттенком.

Раствор I используется для оксидирования меди, II – латуни и оловянистой бронзы, III – преимущественно для сплавов, содержащих 50-70 % меди.
Персульфат калия, применяемый для растворов I и II, должен быть предварительно проверен, так как при длительном хранении он склонен к разложению. При приготовлении ванны в горячий раствор щелочи постепенно вводят порошок персульфата. При температуре раствора ниже 60 °С ухудшается внешний вид оксидной пленки, значительное ее повышение приводит к увеличению расхода K2S2O8. При работе ванны происходит изменение ее состава, что влияет на качество оксидных пленок. Увеличение концентрации едкой щелочи свыше 70 г/л повышает скорость растворения металла и приводит к образованию толстых, но рыхлых пленок. Одновременно увеличивается расход персульфата за счет его химического разложения. Снижение концентрации щелочи ниже 45 г/л сопровождается формированием тонких пленок, имеющих бурый или зеленоватый оттенок. Повышение концентрации K2S2O8 свыше 25 г/л приводит к получению тонких оксидных пленок бурого оттенка, а уменьшение ниже 5 г/л – к образованию толстых и рыхлых пленок. Корректирование растворов I и II проводят через каждые 8-10 ч добавлением щелочи и персульфата калия.
Продолжительность обработки деталей зависит от состава и температуры раствора, а также от срока его эксплуатации. Внешним признаком окончания процесса формирования оксидной пленки является начало интенсивного выделения пузырьков
Обрабатываемые детали загружают в ванну на медных подвесных приспособлениях. При повторном использовании с их поверхности должна быть предварительно удалена оксидная пленка. Для этого достаточно протравить приспособления в течение 0,5-1 мин в 20 %-ном растворе HCI.
В процессе оксидирования следует покачивать детали в ванне, что способствует получению равномерной пленки по всей их поверхности. Необходимо также предотвратить соприкосновение деталей со стальными стенками ванны. Оксидировочный раствор не следует перемешивать, так как при этом может произойти взмучивание шлама и частичное осаждение его на детали. Накапливающийся при работе раствора на дне ванны шлам окиси меди следует периодически удалять.
Раствор III приготавливают из свежеосажденной углекислой меди. Для получения 50 г указанной соли в нагретой до 60- 70 °С конденсатной воде растворяют 125 г CuS04-5H20 и добавляют 50 г Nа2СОз, растворенного в минимальном количестве воды. Выпавший при реакции зеленоватый осадок отфильтровывают, промывают водой, растворяют в аммиаке и выдерживают полученный раствор в течение 10-12 и, после чего добавляют в него требуемое количество воды.
При оксидировании деталей в растворе III в нем уменьшается концентрация аммиака, накапливаются компоненты обрабатываемых сплавов, в результате побочных реакций образуется сильный восстановитель – гидразин, что ухудшает качество оксидных пленок. Для поддержания требуемого состава раствора его регулярно корректируют добавлением аммиака и периодически удаляют из него гидразин, окисляя его кислородом воздуха, который пропускают под давлением через ванну в течение 30-40 мин. В растворе III можно обрабатывать детали как на подвесных приспособлениях, так и в сетчатых медных корзинах, при обязательном их встряхивании. Рекомендуется перед оксидированием латунных деталей проводить их двойное активирование в течение 15-20 с сначала в растворе, содержащем 70 г/л К2Сr2О7 и 40 г/л H2SO4, и затем в 5 %-ном растворе H2SO4. Такая обработка положительно сказывается на защитной способности оксидных пленок.
Во всех случаях более высокое качество оксидирования и интенсивная черная окраска пленок достигаются при обработке меди, а не ее сплавов. Поэтому целесообразно латунные или бронзовые детали предварительно меднить, а потом подвергать оксидированию. Толщина осаждаемого при этом слоя меди достигает 2-3 мкм.
В отличие от химических способов, электрохимическое оксидирование позволяет обрабатывать не только медь, но и большинство ее сплавов – латунь Л63, Л68, ЛС59, оловянно-фосфористую бронзу и ряд других. Формирование оксидной пленки происходит при анодной обработке металла в горячем щелочном растворе. Электролит отличается низкой стоимостью и стабильностью при эксплуатации. Хотя электрохимический способ оксидирования более трудоемок, учитывая высокое качество получаемых при такой обработке оксидных пленок и возможность оксидирования различных медных сплавов, его следует шире использовать в промышленности.
Анодное оксидирование меди и ее сплавов ведут в электролите, содержащем 150-200 г/л NaOH при 80-100 °С, анодной плотности тока 0,8-2,0 А/дм 2 и продолжительности процесса 10-30 мин. На окончание процесса оксидирования указывает появление пузырьков газа у обрабатываемых деталей или резкое повышение напряжения на ванне.
Рассматривая влияние условий электролиза на качество получаемых пленок, можно отметить следующее. С повышением плотности тока возрастает число возникающих на поверхности металла кристаллических зародышей окиси меди. При этом создаются условия для повышения скорости формирования пленки, но толщина ее будет небольшой, так как смыкание кристаллических зародышей окисла происходит быстрее, чем увеличение их толщины. Для получения плотной пленки возможно большей толщины целесообразно начинать процесс при меньшей плотности тока – 0,1-0,5 А/дм 2 и через небольшое время повышать ее до 0,8-1,5 А/дм 2 . Напряжение источника тока 6 В.
При повышении температуры электролита расширяется диапазон плотностей тока, при которых получаются оксидные пленки черного цвета, но увеличивается скорость растворения металла. Понижение температуры ниже 55 °С приводит к формированию слегка рыхлых пленок с зеленоватой окраской.
С понижением концентрации щелочи в растворе уменьшается толщина формирующейся пленки, сужается область плотностей тока, при которых получаются доброкачественные покрытия, ухудшается рассеивающая способность ванны. Превышение оптимальной концентрации щелочи сопровождается получением рыхлого оксидного слоя, снижением прочности сцепления его с металлом. Указанные обстоятельства свидетельствуют о необходимости соблюдать оптимальные условия электрохимического оксидирования, которые указаны выше. Свежеприготовленный электролит прорабатывают с медными анодами до появления светло-голубой окраски раствора. Контроль и корректирование его сводятся к определению щелочности и периодическому добавлению NaOH.
Если в щелочном электролите не удается достигнуть интенсивно черной окраски оксидной пленки, то целесообразно добавить в него 0,1-0,3 % молибденовокислого аммония или молибденовокислого натрия; фосфористую бронзу лучше оксидировать в электролите, содержащем (г/л): 400NaOH, 50К2Сг27, 10(NH2)2MoO4, температура электролита 80-100 °С, анодная плотность тока 2-4 А/дм .
При анодном оксидировании детали загружают в ванну на медных подвесных приспособлениях, которые должны обеспечить надежный электрический контакт с деталями и анодной штангой. В качестве катодов можно использовать сталь или никель. Соотношение поверхностей катода и анода 5:1 -10:1, расстояние между электродами 80-100 мм. Выгрузку оксидированных деталей из ванны проводят под током. Если на поверхности деталей остался рыхлый налет, его удаляют влажной волосяной щеткой. После тщательной промывки детали сушат при 90-100 °С. Для повышения защитной способности оксидной пленки ее пропитывают минеральным маслом или покрывают бесцветным лаком.
Помимо анодной обработки, для получения на поверхности меди и ее сплавов защитно-декоративного покрытия черного цвета предложена катодная обработка в растворе молибдата аммония и ацетата натрия, в который для интенсификации процесса вводятся фторбораты цинка, никеля и натрия при следующем соотношении концентрации компонентов (г/л): молибдат аммония 10-30, ацетат натрия 10-20, фторборат цинка 10-20, фторборат никеля 20-40, фторборат натрия 20-30.
В последние годы были проведены работы, которые показали возможность получения оксидных покрытий электрохимическим путем с использованием не постоянного, а переменного тока промышленной частоты.
Оксидирование меди ведут в 0,01 н. растворе едкого натра. С увеличением плотности тока, температуры раствора и продолжительности обработки наблюдается изменение цвета формирующейся пленки от оранжевого к лиловому, коричневому до черного. Повышение концентрации щелочи приводит к получению сине-зеленой или оливковой окраски пленок. Как применение более концентрированных растворов щелочи, так и повышение температуры ускоряют переход от светлых тонов пленки к темным.
В 0,25 н. растворе гидроксида натрия, нагретом до 40 °С, при продолжительности электролиза 10 мин, плотности тока 1-2 А/дм 2 формируются оксидные покрытия светлых тонов, а при 2-4 А/дм 2 – более темные, почти синего цвета. Повышение температуры электролита до 60 °С расширяет диапазон плотностей тока, при которых получаются покрытия темных оттенков, до 2-6 А/дм 2 . Наряду с этим, при плотности тока 2-3 А/дм 2 пленки коричневого цвета с сине-зеленым отливом можно получить в растворах с довольно широким диапазоном концентрации гидроксида натрия – 0,25-1,0 н.
Оксидирование меди и ее сплавов с использованием переменного тока можно рассматривать, как перспективный способ декоративной отделки медных и омедненных изделий. Простой и стабильный в эксплуатации электролит, небольшие затраты на электроэнергию указывают на экономичность этого способа и целесообразность его освоения производством.
Автор: Администрация
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Что делать, когда течет бачок унитаза: 14 проблем и самостоятельное их решение

Когда в доме течет бачок унитаза, потребление воды может увеличиться до 10 раз. Причины могут быть разные: неисправность клапана, поломки поплавочного механизма, износ шлангов. Исправить все это можно своими руками самостоятельно, не прибегая к услугам сантехника.
В этой статье мы рассмотрим основные причины протекания бачка и их устранение. А также расскажем о профилактике сливной системы унитаза, чтоб избежать их в будущем.
Конструкции современных моделей
Существуют несколько конструкций сливного бачка. Первая — это устаревшая модель у которой запорным клапаном является резиновая груша. Второй состоит из двух узлов: устройство слива и поплавкового модуля. Чаще всего используется вторая конструкция. Дома или в квартире мы чаще используем унитаз с кнопкой.
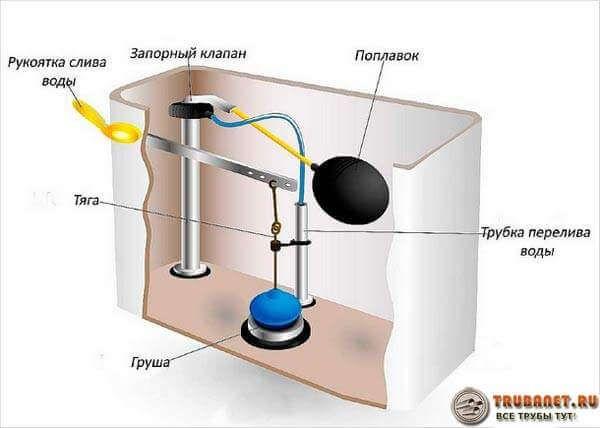
Для того чтобы понять, почему течет бачок унитаза с кнопкой, разберем схему и детали сливной системы.
Схема и детали
Любая схема состоит нескольких узлов:
- Устройство для слива воды — это сливная труба, механизм спуска воды и клапан, который перекрывает слив воды в унитаз. Когда мы нажимаем на кнопку слива поднимается клапан. Вода из бачка вытекает с большой скоростью через сливную трубу.
- Запорный механизм – это кран, который автоматически перекрывает воду. Кран открывается, как только уровень воды уменьшился. Поплавок, по мере наполнения бака, поднимется до определенной высоты и закрывает кран.
- Система перелива – защищает квартиру от затопления, если выйдет из строя запорный механизм. Когда уровень воды становится выше определенного значения, система перелива обеспечивает ее сток в унитаз.
Как работает механизм слива
В основе смыва положен принцип выталкивания поплавкового модуля. Когда мы нажимаем на кнопку клапан слива воды поднимается, и она быстро стекается через сливную трубу. Как только начинает стекать вода из сливного бачка, поплавок опускается и открывает подачу воды. По мере увеличения уровня воды поплавок поднимается и закрывает подачу.
Может Вам будет полезна статья «Установка унитаза своими руками: пошаговая инструкция подключения» Перейти>>
Признаки подтекания
Если протекает бачок, то можно наблюдать следующее:
- слышны падающие капли воды или стекающий ручеек;
- можно увидеть ржавые подтеки, известковые отложения на стенках бачка;
- в чаше унитаза виден не большой влажный след, который остается после смыва;
- появление конденсата с внешней стороны или на шлангах;
- вода, после нажатия на кнопку, не уходит быстро.
Если вода не сливается быстро или неправильно определен уровень, то давление воды не достаточно для прохождения отходов через гидрозатвор. И часть остается в чаше унитаза.
Как только вы обнаружили один из перечисленных признаков, необходимо определить причину и устранить не исправность.
Список необходимых инструментов
Для того чтобы устранить течь необходимо обзавестись некоторыми инструментами и расходными материалами. В процессе ремонта необходимо заменять не пригодные уплотнители, шланги, прокладки.
Когда протекает бачок унитаза то Вам может понадобиться:
- герметик для сантехнических работ (силиконовый);
- наждачная бумага;
- средство для удаления известкового налёта;
- набор отверток;
- нож;
- плоскогубцы;
- набор ключей;
- фум-лента (уплотнительная лента для воды).
Как устранить течь в унитазе
Когда Вы определили, почему течет бачок унитаза, подготовили нужные инструменты, расходные материалы. То только тогда можете приступать к ремонту.
Далее рассмотрим основные причины и порядок действий при устранении проблем.
Переполнение
Что делать, если течет унитаз после смыва. Когда вода в бачке поднялась до нужного уровня и все равно продолжает сливаться в унитаз, то причиной является переполнение. Для начала необходимо определить причину течи, их может быть несколько.
Снимите крышку бачка и выполните несколько простых тестов:
- Чуть-чуть потяните поплавок вверх и держите его. Если течь сразу прекратилась, то поплавок находится выше предельного уровня. Находясь на этом уровне он не может перекрыть воду. Вода стекает через систему перелива и уровень воды не увеличивается. Переместите поплавок ниже, используя рычаг фиксирующий его положение. Если рычаг проволочный, то немного подогните его, чтоб он опустился ниже.
- Если это не помогло и вода продолжает стекаться, то необходимо более тщательно исследовать клапан. Проверьте, не деформирована ли шпилька, нет ли ржавчины, следов коррозии. Ее задача остановить рычаг поплавка. Если это так, то ее можно заменить медной проволокой такого же диаметра.
- Также посмотрите на отверстие, куда проходит шпилька. Оно не должно быть деформировано. Если есть повреждения или деформация, то необходимо заменять весь клапанный механизм.
- Подтекать может из-за прокладки. Чтобы проверить плотно прижмите ее к клапану. Если вода перестала течь, то нужно увеличить прижатие. Когда это не получается, то необходимо ее заменить.
Все эти действия почти всегда помогают найти и устранить течь. Если это не помогло, то необходимо исследовать другие узлы.
Не держит сливной клапан
Если бачок постоянно пропускает воду в унитаз, скорее всего, что вышел из строя клапан сливного узла. Такая проблема появляется, если долго эксплуатируется сантехника. Сливной клапан деформируется, эластичность резины ухудшается, он плохо прилегает, и вода течет в унитаз.
Если это так, то нужно заменить весь сливной механизм. Не тратте время и силы на ремонт узла. Желательно приобрести механизм слива той же фирмы.
Подтекает в местах соединения бачка и унитаза
Когда подтекает в местах соединения бачка и унитаза, проблема может быть в поврежденных соединительных болтах или прокладках. Такая ситуация бывает как с пластмассовыми, так и с железными крепежными болтами.
Необходимо внимательно все осмотреть и попытаться определить причину подтекания. Проблема может быть в деформированных прокладках, либо в болтах. Заранее приобретите комплект крепежных болтов. Для замены лучше всего полностью разобрать бачок.
Для это выполните последовательность действий:
- перекройте подачу воды;
- слейте всю воду с бачка;
- снимите гибкую подводку;
- извлеките арматуру бачка;
- открутите крепежные болты;
- удалите загрязнения и налет;
- установите новые крепежные болты;
- затяните гайки;
- установите арматуру откройте подачу воды.
Протекает бачок унитаза – 9 методов устранения течи
Чтобы починить сливной бачок, в большинстве случаев, нужно произвести замену мембраны. Для этого, спускаем воду из бачка, чтобы не произошла утечка. Откручиваем гайку, соединяющую сливной бачок со смывной трубой. Ослабляем гайку сифона, которая расположена в основании бачка. Отсоединяем сифон от рычага спуска воды и вынимаем его. После этого заменяем мембрану и собираем сливной бачок в обратной последовательности.
Что делать если протекает бачок унитаза? Неисправность устройства, может быть вызвана повреждением одного из компонентов конструкции. В большинстве случаев функционирование нарушается вследствие неисправности сифона, креплений, запорного механизма, резиновой груши или прокладки.
Иногда унитаз подтекает вследствие физического повреждения бака или чаши сантехнического прибора.
Подобные неисправности способны принести множество неприятностей жильцам квартиры, поэтому рекомендуется не откладывать осуществление ремонта.
Провести процедуру ремонта можно самостоятельно. В данной статье мы подробно разберем причины вызывающие данную неисправность и методы их устранения.
Почему течет бачок — основные причины
Если вы задались вопросом — почему течет бачок унитаза, значит проблема уже наступила. Теперь осталось выяснить причину, почему это может происходить. Самая распространенная – обыкновенное переполнение, при котором лишнее количество жидкости смывается. Выделяют несколько основных факторов, которые в большинстве случаев приводят к нарушению работы:
- ухудшение эластичных свойств резиновой прокладки. Со временем данный материал изнашивается, вследствие чего водный поток не может быть плотно перекрыт и сантехника протекает. Деформированная деталь отлично пропускает воду;
- резиновая прокладка не потеряла эластичность и не подверглась деформации, однако она не слишком плотно прилегает к выводному отверстию, расположенному рядом с клапанным механизмом. В следствии неплотного прижимания детали сливной бачок унитаза подтекает;
- шпилька клапанного механизма подверглась коррозийной деформации или физическому повреждению. Эта деталь сохраняет поплавок в требуемом положении, но при длительной эксплуатации элемент перетирается;
- клапанный корпус был поврежден – еще одна причина протечки. Однако трещины, ставшие причиной того, что течет сливной бачок унитаза, возникают только на пластиковых изделиях. Если установлены детали, изготовленные из латуни, такие проблемы не возникнут, т.к. латунные компоненты известны повышенной прочностью.
К прочим распространенным причинам того, что протекает бачок унитаза, относится:
- повреждение болтов и других креплений, соединяющие сливной бак и унитаз. Спустя продолжительный срок эксплуатации металлические элементы часто подвергаются коррозии, а пластиковые – ломаются;
- если из-под бачка унитаза течет при сливе, то дело может быть в груше, которая со временем лишилась эластичности. После длительного использования эта деталь теряет свои первоначальные свойства, вследствие чего пропадает способность обретать необходимую форму.;
- смещение рычага, фиксирующего положение поплавка. Это может произойти вследствие продолжительной эксплуатации в результате которой поплавок теряет герметичность. Поэтому в поплавок может попадать жидкость. Иногда комплектующие низкого качества также вызывают подобную неисправность и сантехника подтекает;
- поломка сифона либо шлангов бака;
- между бачком и унитазом может течь вода вследствие нарушения герметичности соединения. Как правило, это происходит при изменении формы уплотнителя, сделанного из резины;
- поврежден запорный клапанный механизм;
- возникли трещины.

К главным признакам того, что бачок унитаза подтекает, относится:
- часто возникающий или постоянный звук льющейся жидкости;
- появление следов известняка в местах выхода жидкости;
- поверхность чаши, которая расположена ближе к бачку, изнутри постоянно мокрая, даже если сантехникой длительное время не пользовались;
- вода при сливе проходит медленно;
- увеличивается расход воды;
- на трубопроводе и сливном баке возникает конденсат.
Появление даже одной из вышеперечисленных проблем свидетельствует о том, что бачок унитаза подтекает. В этом случае требуется осуществить ремонтные работы. Предлагаем ознакомиться с устройством сливного бачка унитаза, распространенными неисправностями и их ремонтом.
Необходимые инструменты и материалы
Если сантехника протекает, то перед выполнением любых ремонтных работ необходимо перекрыть воду. В следствии того, что жидкость подается в систему под напором, в процессе устранения неисправности можем залить помещения. Для ремонта потребуются следующие инструменты:
- средство-герметик, подходящий для сантехнических приборов;
- наждачная бумага;
- отвертка;
- мешковина, бечевка либо пакля;
- молоток;
- нож;
- плоскогубцы;
- при необходимости замены комплектующей потребуется рабочая деталь определенного вида.
Когда необходимый инструментарий собран, можно начинать производить ремонтные работы.

Как устранить течь бачка унитаза
После того, как была найдена причина, почему течет унитаз, можно приступать к ремонтно-восстановительным работам. Следует отметить, что устранение проблемы немного отличается в отдельных случаях, во многом процедура зависит от формы модели.
 Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды.
Кетчуп – возьмите немного кетчупа из томатов, смажьте им изделие и оставьте на пару минут. После сполосните струей чистой и прохладной воды. Может Вам будет полезна статья «Установка унитаза своими руками: пошаговая инструкция подключения» Перейти>>
Может Вам будет полезна статья «Установка унитаза своими руками: пошаговая инструкция подключения» Перейти>>




