Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 1 :
- Li – 2s 1
- Na – 3s 1
- K – 4s 1
- Rb – 5s 1
- Cs – 6s 1
- Fr – 7s 1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl – галит (каменная соль)
- KCl – сильвин
- NaCl*KCl – сильвинит

Получение
Получить такие активные металлы электролизом водного раствора – невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно – безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий – пероксид, калий, рубидий и цезий – супероксиды.
K + O2 → KO2 (супероксид калия)
Реакции с неметаллами
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Реакция с водой
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда – взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH – натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: “. в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет”. Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий – в желтый, калий – в фиолетовый, рубидий – синевато-красный, цезий – синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание – реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание – мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам – растворимым основаниям. Наиболее известные представители: NaOH – едкий натр, KOH – едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде – хлор)

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке – получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке – получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 – получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 – получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов – смешанных оксидов (при высоких температурах – прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел – смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам – и азотной, и азотистой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Функциональные покрытия металлопроката на основе фосфатов щелочных металлов Текст научной статьи по специальности « Химические технологии»
Аннотация научной статьи по химическим технологиям, автор научной работы — Власова Е. В., Карасик Т. Л., Левко Е. Н., Коваленко В. Л., Лизогуб А. А.
Исследованы свойства функциональных покрытий, полученных из водных трех и двукомпонентных растворов фосфатов щелочных металлов с добавками буры и полиакриламида. Полученные результаты позволяют рассматривать такие покрытия в качестве межоперационных и подсмазочных
Похожие темы научных работ по химическим технологиям , автор научной работы — Власова Е. В., Карасик Т. Л., Левко Е. Н., Коваленко В. Л., Лизогуб А. А.
FUNCTIONAL ROLLED METAL COATINGS BASED ON ALKALI METALS PHOSPHATES
The properties of functional coatings, obtained from water threeand two-component solutions of alkali metals phosphates with borax and polyakrylamide additions, are investigated. The results of coatings properties investigation allow us to define them as interoperation and lubricating coatings
Текст научной работы на тему «Функциональные покрытия металлопроката на основе фосфатов щелочных металлов»
концентрації кислоти Вісник НУ “Львівська політехніка”.- Хімія, технологія речовин та їх застосування.- 2001.- N 426.- С.183-186.
6. Яворський В.Т., Гелеш А.Б., Знак З.О. Утилизация отработаных поглотительных тиосульфатных растворов с получением полимерной серы // Сборник научних трудов Междунар. эколог. конгресса “Новое в экологии и безопасности жизнидеятель-ности”.- Санкт-Петербург.- 2000.- С. 388.
Досліджені властивості функціональних покриттів, одержаних з водних три- та двокомпонентних розчинів фосфатів лужних металів із домішками бури та
результати дозволяють розглядати ці покриття у якості міжопераційних та підмастильних
Ключові слова: водні розчини, фосфати лужних металів
Исследованы свойства функциональных покрытий, полученных из водных трех и двукомпонентных растворов фосфатов щелочных металлов с добавками буры и полиакриламида. Полученные результаты позволяют рассматривать такие покрытия в качестве межоперационных и подсма-зочных
Ключевые слова: водные
растворы, фосфаты щелочных металлов
The properties of functional coatings, obtained from water three- and two-component solutions of alkali metals phosphates with borax and polyakrylamide additions, are investigated. The results of coatings properties investigation allow us to define them as interoperation and lubricating coatings
Key words: water solutions, phosphates of alkaline metals ————-□ □—————
УДК 621.793 : 621.771 : 620.197. 3 : 661.63
ФУНКЦИОНАЛЬНЫЕ ПОКРЫТИЯ МЕТАЛЛОПРОКАТА НА ОСНОВЕ ФОСФАТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Кандидат технических наук, доцент, докторант * Кафедра покрытий, композиционных материалов и защиты металлов Контактный тел.: (056) 374-80 -36, 097-651-20-94.
Кандидат технических наук, доцент * Кафедра химической технлогии керамики и огнеупоров Контактный тел.: 066-173-79-31.
Кандидат технических наук, доцент Кафедра покрытий, композиционных материалов и защиты металлов *Национальная металлургическая академия Украины Пр. Гагарина, 4, г. Днепропетровск, Украина, 49 600 Контактный тел.:(056) 374-80 -36, 050-363-65-63 E-mail: elena.levko@mail.ru
Кандидат технических наук, доцент ** Контактный тел.: 050 — 955-14-81
**Кафедра технической электрохимии Украинский государственный Химико-технологический университет, Пр. Гагарина, 8, г. Днепропетровск, Украина, 49 600
E-mail: elena.levko@mail.ru Контактный тел.: 067 — 397-90-81
Наиболее распространёнными средствами межопе-рационной защиты трубной и проволочной заготовок являются неорганические водорастворимые ингибиторы на основе нитритов и хроматов. Однако опыт
их практического применения показывает, что эти составы имеют целый ряд недостатков, к которым относятся вредность и плохие условия труда. К тому же применение хроматов экологически небезопасно из-за их токсичности и сложности обезвреживания [1, 2].
Применение водных растворов фосфатов щелочч ных металлов для разработки эффективных атмосферостойких, экологически безопасных, сравнительно дешевых покрытий, обладающих функциональной связью с технологией производства металлопроката является одним из перспективных направлений в области межоперационной защиты металлической поверхности, которая в дальнейшем подвергается холодной деформации, эмалированию, покраске и пр. [3 – 6].
Целью проведенных исследований являлось получение из водных растворов фосфатов щелочных металлов с добавками буры и полиакриламида функциональных покрытий с высокими защитными свойствами, предназначенных для предотвращения атмосферной коррозии металлопроката из углеродистых марок сталей, а также использование их в качестве подсмазочных в процессах холодной деформации.
Для получения покрытий использовали водные двухкомпонентные растворы, составы (мас.%) которых приведены ниже: 4 – тринатрийфосфат (ТНФ); 0,5 – 1,1
– полиакриламид (ПАА); 4 – триполифосфат натрия (ТПФ) и (ПАА) с указанным содержанием, а также водные трехкомпонентные растворы: 6, 12 – ТПФ; 0,5, 4 – буры и 0,03,
Покрытия наносили на поверхность прямоугольных образцов, размером 40x37x1 мм из стали 0,8кп, предварительно обработанных в 15 мас.% растворе серной кислоты для снятия остаточной ржавчины и промытых в холодной воде, которые погружали в растворы для нанесения покрытий. Температура растворов составляла 70оС, время выдержки
1 минуту. Сушку образцов с покрытиями производили на воздухе в течение суток.
Удельную массу и маслоемкость покрытий определяли гравиметрическим методом. Удельную массу покрытий оценивали отношением разницы массы до и после нанесения покрытия к площади образца; маслоемкость покрытий – отношением разницы массы до и после окунания в масло образца с покрытием к его площади. Для сравнения использовали результаты исследований маслоемкости традиционных подсмазочных покрытий, которые получали путем меднения, желтения, фосфатирования, оксалатирования, известкования, а также покрытие слоем жидкого стекла и буры [1, 7]. Пористость покрытий определяли наложением на поверхность образца с покрытием фильтровальной бумаги, смоченной раствором, содержащим красную кровяную соль, и выдерживали в течение 5 минут. При этом в порах покрытия образовывались точки турнбуллиевой сини. Через 5 минут бумагу снимали, промывали водой, высушивали и подсчитывали среднее число отпечатавшихся на бумаге точек, приходящихся на 1 см2 поверхности. Поверхность 100 точек на 1 см2 условно принимали за 100 %.
Защитные свойства покрытий оценивали временем появления первых очагов коррозии (час). Данный по-
казатель фиксировали при ускоренных испытаниях образцов с покрытиями в термогидростате при температуре 45°С и влажности 100% и при натурных испытаниях в атмосферных условиях при температуре 5 -10оС и влажности 70 – 90 оС.
Результаты исследований физико-химических свойств покрытий, полученных из двухкомпонентных растворов, представлены в таблице 1.
Как видно из представленных данных при повышении содержания ПАА в растворах фосфатов щелочных металлов от 0,5 до 1,1 мас. %, удельная масса покрытий возрастает в 6 – 8 раз, пористость снижается в 2,4 -3,7 раза, время появления первых очагов коррозии повышается с 72 – 120 до 148 – 216 часов. При этом показатель коррозии стали 08 кп без покрытия составляет 24 часа. Следовательно, повышение содержания ПАА в водных растворах ТНФ и ТПФ способствует получению покрытий с более высокими защитными свойствами.
На рис. 1 представлены результаты исследования маслоемкости покрытий.
Из рис. 1 видно, что показатель маслоемкости исследуемых функциональных покрытий составляет 23,13 – 35,97 г/м2, что соответствует средним значениям маслоемкости подсмазочных традиционных покрытий (4,32 – 57,46 г/м2). При этом для функциональных покрытий, пористость которых составила 37 %, маслоемкость соответствует 35,97 г/м2. С уменьшением пористости до 9 % маслоемкость снижается до 23,13 г/м2. Это указывает на то, что маслоемкость таких покрытий напрямую зависит от их пористости.
Результаты исследования физико-химических свойств функциональных покрытий, полученных из водных трехкомпонентных растворов, представлены в таблице 2.
Физико-химические свойства функциональных покрытий, полученных из двухкомпонентных водных растворов
Свойства покрытий Составы водных растворов, мас.%
0,5 0,7 0,9 1,1 0,5 0,7 0,9 1,1
Удельная масса, г/м2 0,47 0,66 1,13 2,57 0,35 0,52 1,24 2,63
Пористость, о/ % 22 16 10 9 37 24 15 10
Время повле-ния первых очагов коррозии,час 120 144 216 216 72 120 126 148
Рис.1. Маслоемкость подсмазочных традиционных (1 —  и исследуемых функциональных покрытий (9 — 16): красный — традиционные покрытия, синий — опытные покрытия; 1 – желтение, 2 – оксалатирование, 3 – омеднение, 4 -фосфатирование, 5 – известкование, 6 – бурирование, 7 – раствор ТНФ+бура+мыло, 8 – покрытие жидким стеклом, 9 – раствор ТНФ+ПАА 0,5%, 10 – раствор ТНФ+ПАА 0,7%, 11 – раствор ТНФ+ПАА 0,9%, 12 – раствор ТНФ+ПАА 1,1%, 13 – раствор ТПФ+ПАА 0,5%, 14 -раствор ТПФ+ПАА 0,7%, 15 – раствор ТПФ+ПАА 0,9%, 16 – раствор ТПФ+ПАА 1,1%
и исследуемых функциональных покрытий (9 — 16): красный — традиционные покрытия, синий — опытные покрытия; 1 – желтение, 2 – оксалатирование, 3 – омеднение, 4 -фосфатирование, 5 – известкование, 6 – бурирование, 7 – раствор ТНФ+бура+мыло, 8 – покрытие жидким стеклом, 9 – раствор ТНФ+ПАА 0,5%, 10 – раствор ТНФ+ПАА 0,7%, 11 – раствор ТНФ+ПАА 0,9%, 12 – раствор ТНФ+ПАА 1,1%, 13 – раствор ТПФ+ПАА 0,5%, 14 -раствор ТПФ+ПАА 0,7%, 15 – раствор ТПФ+ПАА 0,9%, 16 – раствор ТПФ+ПАА 1,1%
Физико-химические свойства функциональных покрытий, трехкомпонентных водных растворов
Свойства покрытий Состав водных растворов, мас.%
ТПФ Бура ПАА ТПФ Бура ПАА
6,0 0,5 0,03 12,0 4,0 0,8
Удельная масса, г/м2 1,87 2,41
Пористость, % 1,2 0,4
Время повления первых очагов коррозии,час Ускоренные испытания 147 149
Натурные испытания 519 536
Результаты, приведенные в таблицах 1 и 2 показывают, что малопористые (1,2 – 0,4 %) покрытия, полученные из трехкомпонентных растворов на основе три-полифосфата натрия характеризуются повышением защитных свойств в атмосферных условиях в 3 раза, по сравнению с пористыми (9 – 37 %) – двухкомпонентными. Следовательно, одной из основных причин повышения их защитных свойств, можно считать значительное уменьшение пористости.
Более высокие противокоррозионные свойства этих покрытий могут быть объяснены комплексным
действием добавок буры и ПАА в водном растворе три-полифосфата натрия.
В частности, бура, обладая буферными свойствами, хорошо растворяясь, гидролизует, усиливая и сохраняя щелочную реакцию водного раствора ТПФ при изменении его содержания (от 6 до 12 мас.%), что положительно сказывается на сплошности и защитных свойствах получаемых покрытий.
Введение дополнительно в раствор ПАА, являющегося карбоцепным полимером, приводит к усилению полимерной структуры ТПФ, что также позволяет получать более сплошное равномерное покрытие. При этом в водных растворах ПАА постепенно гидролизует до аммониевой соли полиакриловой кислоты, что дополнительно укрепляет структуру защитного покрытия и приводит к повышению его защитных свойств.
1. Установлено, что функциональные покрытия, полученные из водных трех и двухкомпонентных растворов фосфатов щелочных металлов с добавками буры и ПАА, указанных содержаний, обеспечивают защиту стали 08кп в условиях атмосферной коррозии от 216 до 536 часов. При этом для малопористых покрытий, полученных из трехкомпонентных растворов, защитные свойства в атмосферных условиях в 3 раза выше, чем для пористых, полученных из двухкомпонентных.
2. Полученные результаты позволяют рекомендовать трехкомпонентный состав, содержащий (мас. %) 6
– 12 ТПФ, 0,5 – 4 буры, 0,03 – 0,8 ПАА для межоперационной защиты металлопроката из углеродистых марок стали [8].
3. Показано, что покрытия, полученные из водных двухкомпонентных
растворов фосфатов щелочных металлов с добавкой ПАА (указанных составов), имеющие пористость 9 -37%, могут наряду с защитной выполнять функцию подсмазочного покрытия, так как их маслоемкость соответствует средним значениям маслоемкости под-смазочных традиционных покрытий.
4. Увеличение содержания ПАА в водном растворе фосфатов щелочных металлов сопровождается получением покрытий с большей удельной массой, меньшей пористостью и как следствие большей защитной
Таблица 2 полученных из
способностью, но меньшей маслоемкостью.
1. Липкин Я.Н. Химическая и электрохимическая обработка стальных труб./Я.Липкин, В. Штанько – М.: Металлургия, 1974.-216 с.
2. Улиг Г.Г Коррозия и борьба с ней. Введение в коррозионную науку и технику / Улиг Г.Г., Реви Р.У., – Л.: Химия, 1989. – С. 456.
3. Аскользин А.П. Противокоррозионная защита стали пленкообразователями. – М.: Металлургия, 1989. -192 с.
4. Кузнецов Ю.И. Ингибиторы коррозии в конверсионных покрытиях III / Ю.И. Кузнецов //Защита металлов от коррозии.
– 2001. – Т. 37, № 2. – С. 119 – 125.
5. Власова Е.В. Исследования свойств межоперационных покрытий /Власова Е.В., Карасик Т.Л., Никифорова Н.А. // Теория и практика металлургического производства.- 2007.- № 2.- С.53-57.
6. Власова Е.В. Исследование покрытий, полученных из водных растворов фосфатов./Власова Е.В., Карасик Т.Л., //Металлургическая и горнорудная промышленность.- 2010.- № 5.- С.89-91.
7. Шахпазов Х. С. Производство метизов /Шахпазов Х.С., Ориничев В.И. – М.: Металлургия, 1977. – 392 с.
8. Пат. 35572 Україна, МПК С23F11/06 Склад для нанесення захисного покриття на металеву поверхню. Карасик Т.Л., Власое ва О.В. – NU200805382 Заявл. 24.04.2008; Опубл. 25.09.2008, Бюл. 18 – 4 с.
У статті наведені результати досліджень методом ІЧ-спектроскопії гідрофобізуючих фторорганічних
препаратів, які використовуються для надання кислотозахисних властивостей текстильним матеріалам
Ключові слова: ІЧ-спектроскопія, фторорганічні препарати, кислотоза-хисна обробка
В статье приведены результаты исследований методом ИК-спектроскопии гидрофобизирую-щих фторорганических препаратов, используемых для придания кислотозащитных свойств текстильным материалам
Ключевыеслова:ИК-спектроскопия, фторорганические препараты, кислотозащитная отделка
The results of researches by a method of IR-spectroscopy of fluoro-organic finishing preparations, which are processed for giving the acid proof properties to the textile materials, are presented in the article
Key words: IR- spectroscopy, fluoro-organic preparations, acid proof finishing —————–□ □——————-
УДК 677.862.52 : 677.016.67
ИЗУЧЕНИЕ ИК-СПЕКТРОВ ФТОРОРГАНИЧЕСКИХ ПРЕПАРАТОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ КИСЛОТОЗАЩИТНОЙ
Доктор технических наук, доцент Профессор кафедры химической технологии и дизайна
волокнистых материалов Херсонский национальный технический университет Бериславское шоссе, 24, г. Херсон, 73008 Контактный тел.: 0505893242 E-mail:dina15box@mail.ru
Кандидат технических наук, ведущий эксперт отдела специальных видов исследования НИЭКЦ при УМВД Украины
в Николаевской области. Научно-исследовательский экспертно-криминалистический центр при УМВД Украины в Николаевской области.
ул. Акима 2а, г. Николаев, 54003 Контактный тел.: +38-050-3916194 E-mail: mikroskop56@mail.ru
Свойства веществ и характер взаимодействия с другими соединениями, как известно, во многом зависят от их химического строения.
Фторорганические препараты (ФОП) имеют общее строение С^2П+1 – X, где Х – активные группы, в качестве которых могут быть остатки линейной (б) или циклической мочевины (в), а также акриловой кислоты (а) (Рис. 1) [1].
Это препараты для придания гидро- и олеофоб-ности текстильным материалам. Фторсодержащие полимеры, используемые для отделки текстильных изделий, состоят из полимерных структур на основе полиакрилатов, полиуретанов и др., содержащих в бо-
ковых цепях макромолекул перфторированные группы. Большое влияние на свойства готового продукта оказывают длина и форма основной цепи макромолекулы, а также характер концевых групп фторсодержащих боковых цепей.
Основными производителями фторорганических препаратов является ряд известных иностранных фирм «Ciba» (Oleophobol), «Rotta» (Dipolit), «Color-tech» (Repellent), «Крата» (Кратан ВГО).
Расширение возможностей современной ИК-спектроскопии связано с появлением ИК-комплекса AVATAR 360 – CONTINUUM, в комплект которого входят микроскоп, ИК-Фурье спектрометр, компьютер
Фосфор, его соединения: . фосфаты щелочных металлов – C01B 25/30
Патенты в данной категории
Изобретение может быть использовано в химической промышленности и электронике. Фосфат лития-железа оливинового типа состоит из вторичных частиц, имеющих средний диаметр частиц (D50) от 5 до 100 мкм, образованных за счет агрегации первичных частиц, имеющих средний диаметр частиц (D50) от 50 до 550 нм. Фосфат лития-железа имеет состав, представленный формулой Li 1+a Fe 1-x M x (PO 4-b )X b , в которой М выбран из Аl, Mg, Ni, Co, Mn, Ti, Ga, Сu, V, Nb, Zr, Се, In, Zn, Y и их комбинаций, X выбран из F, S, N, при этом -0,5  а
а  +0,5, 0
+0,5, 0  x
x  0,5 и 0
0,5 и 0  b
b  0,1. Вторичные частицы имеют пористость от 15 до 40%. Заявленный фосфат лития-железа используется в качестве катодного активного материала. Предложенное изобретение позволяет получить фосфат лития-железа, обладающий высокой электропроводностью и прочностью, тем самым увеличить емкость и плотность энергии электродов и батарей. 4 н. и 16 з.п. ф-лы, 8 ил., 4 табл.
0,1. Вторичные частицы имеют пористость от 15 до 40%. Заявленный фосфат лития-железа используется в качестве катодного активного материала. Предложенное изобретение позволяет получить фосфат лития-железа, обладающий высокой электропроводностью и прочностью, тем самым увеличить емкость и плотность энергии электродов и батарей. 4 н. и 16 з.п. ф-лы, 8 ил., 4 табл.
Изобретение может быть использовано в химической промышленности. Фосфат лития-железа с кристаллической структурой оливина имеет состав, выраженный химической формулой (I) L 1+a Fe 1-x M x (PO 4-b )X b (где М выбран из Al, Mg, Ti; X выбран из F, S, N; – 0,5  а
а  +0,5; 0
+0,5; 0  х
х  0,5; и 0
0,5; и 0  b
b  0,1), содержит 0,1-5 мас.% Li 3 PO 4 и не содержит или содержит менее 0,25 мас.% Li 2 CO 3 . Содержание Li 3 PO 4 в составе фосфата лития-железа повышает электрохимическую стабильность и обеспечивает термическую безопасность и ионную проводимость. Фосфат лития-железа по настоящему изобретению может использоваться в качестве активного материала положительного электрода для вторичной литиевой батареи. 5 н. и 10 з.п. ф-лы, 1 табл., 5 ил.
0,1), содержит 0,1-5 мас.% Li 3 PO 4 и не содержит или содержит менее 0,25 мас.% Li 2 CO 3 . Содержание Li 3 PO 4 в составе фосфата лития-железа повышает электрохимическую стабильность и обеспечивает термическую безопасность и ионную проводимость. Фосфат лития-железа по настоящему изобретению может использоваться в качестве активного материала положительного электрода для вторичной литиевой батареи. 5 н. и 10 з.п. ф-лы, 1 табл., 5 ил.
Способ утилизации фосфора из железосодержащих отходов, образующихся при азотнокислотной переработке вятско-камских фосфоритов, в удобрения по азотнокислотной технологии, включает обработку отходов смесью азотной и серной кислот, отделение полученного сульфата кальция фильтрованием, введение в оставшийся раствор раствора NaOH, доведение рН до значений не менее 12, отделение осадка гидроокиси железа (III) фильтрованием и возвращение оставшегося раствора, содержащего фосфат натрия, в процесс получения удобрений. Полученный раствор содержит фосфат натрия без соединений железа, а осадок представляет собой гидроксид железа, содержащий соединения фосфора в количестве 1-1,5% от взятого для переработки. Способ позволяет извлекать фосфор из отходов азотнокислотной переработки вятско-камских фосфоритов с получением полезного продукта, пригодного для использования в процессах получения удобрений. 1 табл.
Изобретение относится к технологии получения неорганических соединений фосфора, а именно к способу получения тринатрийфосфата (ТНФ) из экстракционной фосфорной кислоты. Способ получения тринатрийфосфата включает нейтрализацию фосфорной кислоты кальцинированной содой, разделение раствора и осадка примесных компонентов, нейтрализацию отделенного раствора гидроксидом натрия при pH=11,5-12,0 с получением раствора тринатрийфосфата, его последующим охлаждением, кристаллизацией готового продукта и отделением маточника кристаллизации, при этом нейтрализацию фосфорной кислоты кальцинированной содой ведут сначала до образования раствора, содержащего 12-14% мононатрийфосфата и 27-30% динатрийфосфата, при температуре 55-52°С, а затем добавляют кальцинированную соду до получения раствора динатрийфосфата с концентрацией 40-42%. Целесообразно на стадию нейтрализации отделенного раствора гидроксидом натрия вводить маточник кристаллизации. Способ позволяет повысить степень извлечения P 2 O 5 , улучшить качество продукта и повысить технологичность процесса за счет повышения производительности стадии фильтрации. 1 з.п. ф-лы, 3 табл.
Изобретение относится к технике получения мононатрийфосфата нейтрализацией фосфорной кислоты содой в присутствии насыщенного раствора мононатрийфосфата с изотермической кристаллизацией мононатрийфосфата в ходе нейтрализации кислоты. Способ получения безводного мононатрийфосфата заключается в нейтрализации фосфорной кислоты содой в две ступени в присутствии насыщенного раствора мононатрийфосфата в виде возвратного маточного раствора с подачей на первой ступени 0,45 части фосфорной кислоты с последующей выдержкой в течение 30 минут, а на второй стадии с равномерной подачей остальной 0,55 части в течение 80 минут. Применение способа позволяет повысить экономичность процесса и снизить долю примесей мышьяка в продукте в 1,6 раза, тяжелых металлов в 1,2 раза.
Изобретение относится к технике получения трехзамещенного фосфата натрия нейтрализацией фосфорной кислоты содой до динатрийфосфата и гидроксидом натрия до тринатрийфосфата, выделением кристаллов тринатрийфосфата после охлаждения нейтрализованного раствора. Способ заключается в нейтрализации раствора динатрийфосфата первоначально насыщенным раствором тринатрийфосфата при температуре 60-65°С до соотношения Na 2 O/Р 2 О 5 =2,3-2,5, а затем при температуре 70-80°С раствором гидроксида натрия и выделении тринатрийфосфата охлаждением нейтрализованного раствора со скоростью 7-9 град./час до температуры 53°С. Применение способа позволяет увеличить скорость фильтрации суспензии фосфата и соответственно производительность процесса в 1,2-1,4 раза, производительность фильтрации в 1,4-1,5 раза и повысить содержание Р 2 O 5 в продукте до 20,3-20,6 мас.%. 1 табл.
Изобретение относится к способу получения монокалийфосфата, используемого в качестве удобрений, пищевых добавок, а также в медицине и микробиологии. Способ включает нейтрализацию фосфорной кислоты карбонатом калия до рН не выше 4,5 при повышенной температуре, разделение полученной смеси фильтрацией с последующей кристаллизацией и отделением готового продукта при охлаждении. Карбонат калия берут в виде водного раствора с концентрацией, необходимой для получения в нейтрализованной смеси 23-30% монокалийфосфата, процесс нейтрализации ведут при температуре 70-78°С, а маточный раствор после отделения готового продукта на стадии кристаллизации возвращают в процесс на стадию растворения карбоната калия. Реакцию нейтрализации ведут до рН 3,8-4,5. Технический результат заключается в повышении выхода готового продукта до 95-97% и создании безотходного производства за счет использования маточного раствора в процессе. 1 з.п. ф-лы.
Изобретение относится к способу получения нитрата щелочного металла и фосфата щелочного металла в одном и том же технологическом процессе из фосфатного сырья и нитратного сырья, включающий следующие этапы: а) взаимодействие фосфатного сырья с нитратным сырьем с образованием водной нитрофосфатной реакционной смеси, с последующим необязательным отделением твердого материала, б) введение водной нитрофосфатной реакционной смеси на этап первого ионного обмена, осуществляемого при наличии насыщенной ионами щелочного металла катионообменной смолы, для обмена катионов, присутствующих в реакционной смеси, на ионы щелочного металла, присутствующие в этой смоле, с получением потока, обогащенного ионами щелочного металла, в) осуществление первой кристаллизации потока, получаемого на этапе (б), при условиях, обеспечивающих кристаллизацию нитрата щелочного металла, и отделение кристаллизованного нитрата щелочного металла от маточного раствора, г) введение маточного раствора, образующегося на этапе (в), на этап второго ионного обмена, осуществляемого при наличии насыщенной ионами щелочного металла катионообменной смолы, для обмена катионов, присутствующих в маточном растворе, на ионы щелочного металла, присутствующие в этой смоле, с получением потока, содержащего фосфат, обогащенного ионами щелочного металла, и д) осуществление второй кристаллизации потока, получаемого на этапе (г), при условиях, обеспечивающих кристаллизацию фосфата щелочного металла, и отделение кристаллизованного фосфата щелочного металла от маточного раствора. Заявленный способ эффективен с максимальным использованием сырья или минимальном количестве отходов, требует меньших затрат энергии. 14 з.п. ф-лы, 6 табл., 2 ил.
Щелочные металлы фосфаты
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:
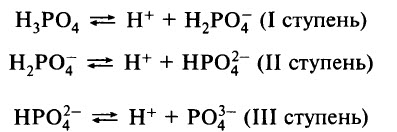
Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
- а) с основаниями:

- б) с основными и амфотерными оксидами:

- в) с солями более слабых и летучих кислот:

В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2O
или
КОН + H3РO4 = КH2РO4 + H2O
Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4 + ) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4 + , n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:

Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО4 3– .
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:

Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:

Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Формула фосфатов
Определение и формулы фосфатов
тем самым образуя соли – фосфаты – трех видов:
— фосфаты – замещены все атомы водорода в фосфорной кислоте, например, K3PO4 –фосфат калия, (NH4)3PO4 – фосфат аммония;
— гидрофосфаты – замещены два атома водорода в фосфорной кислоте, например, K2HPO4–гидрофосфат калия, (NH4)2HPO4 – гидрофосфат аммония;
— дигидрофосфаты — замещены три атома водорода в фосфорной кислоте, например, KH2PO4 – дигидрофосфат калия, NH4H2PO4 – дигидрофосфат аммония.
Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты в воде растворяется лишь дигидрофосфат кальция.
Химическая формула фосфатов
Химические формулы фосфатов рассмотрим на примере калиевых солей фосфорной кислоты: K3PO4 –фосфата калия, K2HPO4–гидрофосфата калия и KH2PO4 – дигидрофосфат калия. Химическая формула показывает качественный и количественный состав молекулы (сколько и каких атомов входит в конкретное соединение) По химической формуле можно вычислить молекулярную массу фосфатов (Ar(K) = 39 а.е.м., Ar(H) = а.е.м., Ar(P) = 31 а.е.м., Ar(O) = 16 а.е.м.):
Mr(K3PO4) = 3×39 + 31 + 4×16 = 117 + 31 + 64 = 212
Mr(K2HPO4) = 2×39 + 1 + 31 + 4×16 = 78 + 1 + 31 + 64 = 174
Mr(KH2PO4) = 39 + 2×1 + 31 + 4×16 = 39 + 2 + 31 + 64 = 136
Графическая (структурная) формула фосфатов
Структурная (графическая) формула является более наглядной. Рассмотрим структурные формулы фосфатов на примере все тех же калиевых солей фосфорной кислоты: K3PO4 –фосфата калия, K2HPO4–гидрофосфата калия и KH2PO4 – дигидрофосфат калия.

Рис. 1. Структурная формула фосфата калия.

Рис. 2. Структурная формула гидрофосфата калия.

Рис. 3. Структурная формула дигидрофосфата калия.
Ионная формула
Фосфаты представляют собой соли разного типа (средние и кислые), каждая из которых способна диссоциировать в водном растворе. Рассмотрим структурные формулы фосфатов на примере все тех же калиевых солей фосфорной кислоты:
Примеры решения задач
| Задание | Составьте формулу соединения водорода, йода и кислорода, если массовые доли элементов в нём: ω(H) = 2,2%, ω(I) = 55,7%, ω(O) = 42,1%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (водород), «у» (йод), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(H)/Ar(H) : ω(I)/Ar(I) : ω(O)/Ar(O);
x:y:z= 2,2/1 : 55,7/127: 42,1/16;
x:y:z= 2,2 : 0,44: 2,63 = 5 : 1 : 6
Значит формула соединения водорода, йода и кислорода будет иметь вид H5IO6.
| Задание | Образец соединения фосфора и брома массой 81,3 г содержит 0,3 моль фосфора. Найдите эмпирическую формулу соединения. |
| Решение | Рассчитаем массу фосфора в соединении (относительная атомная масса равна 31 а.е.м. и численно совпадает со значениями молекулярной и молярной масс): |
m(P) = 0,3 × 31 = 9,3 г
Определим массу брома в составе соединения:
m(Br) = 81,3 – 9,3 = 72 г
Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор) и «у» (бром). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y = m(P)/Ar(P) : m(Br)/Ar(Br);
x:y= 0,3 : 0,9 = 1 : 3
Значит формула соединения фосфора и брома будет иметь вид PBr3.
Гигиена. Конспект лекций

Гигиена как раздел медицины, изучающий связь и взаимодействие организма с окружающей средой, тесно соотносится со всеми дисциплинами, обеспечивающими формирование гигиенического мировоззрения врача: биологией, физиологией, микробиологией, клиническими дисциплинами. Это дает возможность широкого использования методов и данных этих наук в гигиенических исследованиях с целью изучения влияния факторов окружающей среды на организм человека и разработке комплекса профилактических мероприятий. Гигиеническая характеристика факторов среды и данные об их влиянии на здоровье в свою очередь способствуют более обоснованной диагностике заболеваний, патогенетическому лечению.
Оглавление
- Лекция 1. Гигиена как наука
- Лекция 2. Методы оценки эффективности гигиенических мероприятий, дополняющие санитарное описание
- Лекция 3. История развития гигиены
- Лекция 4. Роль воздушной среды. солнечная радиация
- Лекция 5. Гигиеническое значение температуры и влажности воздуха
- Лекция 6. Гигиеническое значение перемещения воздушных масс и атмосферного давления
- Лекция 7. Электрическое состояние атмосферного воздуха
Приведённый ознакомительный фрагмент книги Гигиена. Конспект лекций предоставлен нашим книжным партнёром — компанией ЛитРес.
Лекция 4. Роль воздушной среды. солнечная радиация
1. Роль воздушной среды
Воздушная среда играет важную роль в дыхании человека, животных и растений. Роль воздуха состоит в снабжении кислородом, удалении продуктов обмена веществ, обеспечении процесса теплообмена. Резкие изменения физических свойств и химического состава неблагоприятно отражаются на важнейших функциях организма и приводят к различным заболеваниям.
К физическим факторам воздушной среды относятся: солнечная радиация, температура, влажность, скорость движения воздуха, барометрическое давление, электрическое состояние, радиоактивность.
2. Солнечная радиация
Солнечная радиация — единственный источник энергии, тепла и света на Земле. Она является основным фактором, обуславливающим климат местности. Под солнечной радиацией понимают испускаемый солнцем интегральный поток радиации, который представляет собой электромагнитное излучение. Оптическая часть солнечного спектра разделяется на три диапазона: инфракрасные лучи с длиной волн от 2,8 тыс. до 760 нм, видимая часть — от 760 до 400 нм и ультрафиолетовая часть — от 400 до 280 нм. Солнечная радиация возрастает с увеличением высоты местности над уровнем моря. Так, на высоте 1 тыс. м она составляет около 292,7 × 10 4 Вт/м 2 , а на высоте 3 тыс. м 346,6 × 10 4 Вт/м 2 .
3. Инфракрасная радиация
Инфракрасная радиация составляет большую часть излучения Солнца и по биологической активности делится на длинноволновую (1,5 тыс. — 2,5 тыс. нм) и коротковолновую (760–1,5 тыс. нм). Длинноволновые лучи поглощаются поверхностным слоем эпидермиса, а коротковолновые лучи (длина волны менее 1 тыс. нм) достигают глубоких слоев кожи. Они способны проходить через мозговую оболочку и воздействовать на рецепторы мозга — развитие солнечного удара — возбуждение, судороги, потеря сознания. Под воздействием инфракрасной радиации возможно помутнение хрусталика — катаракта, изменение иммунологической реактивности и др.
4. Ультрафиолетовая радиация
Ультрафиолетовая радиация оказывает наиболее сильное биологическое действие, особенно лучи с длиной волн от 315 до 290 нм. Влияние связано с воздействием на структуру белка. Протеолитические процессы в коже обуславливают появление в крови гистамина и гистаминоподобных веществ. Воздействуя на нервную систему, эти продукты рефлекторно влияют на весь организм.
Ультрафиолетовые лучи (Уф-лучи) являются неспецифическим стимулятором физиологических функций. Под их действием происходит усиление деятельности надпочечников, щитовидной и других желез. Уф-лучи стимулируют белковый, жировой, углеводный и минеральный обмен, влияют на кроветворение и на иммунологические процессы, повышая защитные силы. Уф-лучи обладают бактерицидным действием.
Спектр Уф-излучения делят на: А-излучение с длиной волн от 400 до 315 нм, В-излучение с длиной волн от 320 до 280 нм и С-лучи с длиной менее 280 нм.
Передозировка Уф-облучения может сопровождаться эритроматозным раздражением кожи, недомоганием, головными болями, повышением температуры тела. В тяжелых случаях могут развиваться ожоги, дерматиты с явлениями экссудации и отечностью. Воздействие на органы зрения приводит к фотоофтальмии — гиперемии, отеку конъюнктивы, блефароспазму, слезотечению, светобоязни.
Уф-излучение с длиной волн 320–280 нм способны предупреждать D-витаминную недостаточность. У маленьких детей в результате D-авитаминоза может развиться рахит. У взрослых при D-авитаминозе отмечается ослабление связочного аппарата суставов, снижение плотности костей, замедленное срастание их при переломах.
Имеются данные, подтверждающие способность Уф-радиации при длительном чрезмерном воздействии вызывать злокачественные опухоли, в частности рак кожи.
Бактерицидное действие Уф-радиации используется при санации воздушной среды, обеззараживании молока, дрожжей, напитков и др.
Видимая солнечная радиация определяется в средней полосе России освещенностью в июле около 65 тыс. лк, а в декабре — 4 тыс. лк и менее.
Свет оказывает психофизиологическое воздействие на организм. Так, оранжево-красная часть спектра вызывает возбуждение и усиливает чувство тепла, а холодные тона (сине-фиолетовая часть спектра) усиливают тормозные процессы в центральной нервной системе. Желто-зеленые цвета оказывают успокаивающее влияние. Свет играет ведущую роль в процессах восприятия окружающего мира, в образовании суточного ритма, представляющего собой закономерное чередование периодов покоя и мышечной активности, процессов возбуждения и торможения.
10 горячих вопросов о солнце. Чем опасно инфракрасное излучение и почему мы раньше от него не защищались?

На эти и другие вопрос отвечают эксперты в области красоты. Итак, 10 вопросов о солнце и красивом загаре:
1) Как подобрать солнцезащитное средство для чувствительной кожи?
«Солнцезащитные фильтры бывают физические и химические. Более безопасные — физические. Они не вызывают раздражения на чувствительной и склонной к аллергии коже», — рассказывает врач-дерматокосметолог Ольга Тарасова.
«Чтобы вычислить такой фильтр, изучите упаковку. В состав средства должны входить микрочастицы минеральных веществ, например, оксид цинка или диоксид титана, — добавляет Чой Ен Джун, главный врач клиники. — Они не впитываются, создавая на коже защитный экран, и отражают солнечные лучи».
«Но будьте осторожны, — предупреждает Ольга. — Такие средства редко бывают водостойкими, и их нужно наносить не реже чем раз в полчаса».
2) Как определить нужную мне текстуру солнцезащитного средства?
«Если кожа чувствительная, вам показаны кремы с пометкой «некомедоногенно», если жирная — средства oil-free, – советует дерматолог Инна Орехова. – А солнцезащитное масло за счет своего увлажняющего действия подойдет сухой и нормальной коже».
3) Активаторы загара – это вредно?
«Усилители загара абсолютно безопасны, — уверена дерматолог Наталья Едемская. – Действуя в период активного солнечного воздействия, такие средства увеличивают выработку меланина и при этом улучшают снабжение кожи кислородом, защищая ее от обезвоживания. А в итоге помогают быстро обрести ровный загар».
4) Чем опасно инфракрасное излучение и почему мы раньше от него не защищались?
Как мы помним из уроков физики, инфракрасные лучи, невидимые невооруженным глазом, составляют значительную часть солнечного спектра. Но лишь недавно ученые выяснили, что те достигают самых глубоких слоев кожи, а значит, способны ускорять фотостарение и генерировать образование свободных радикалов, повреждающих ДНК.
«Сегодня не существует молекул, способных поглощать инфракрасные лучи, — констатирует доктор Оливье Дусе. – Но сочетание антиоксидантов и специальных рефлекторов (диоксидатитана, рубина и перламутрового пигмента) сможет обезвредить их большую часть».
5) Зачем принимать витамины для загара?
«Основное преимущество витаминов для загара в том, что их прием можно начать за месяц до отпуска, а значит, кожа
будет готова к солнечным ваннам», — отвечает дерматолог Наталья Едемская.
«Витамины сделают загар более интенсивным и стойким, — комментирует Ольга Тарасова. — Ведь в их состав входят антиоксиданты, бета-каротин и витамины С, А и Е, которые способствуют проявлению загара и увлажняют кожу изнутри».
В качестве дополнительного источника бета-каротина подойдут морковь, помидоры и тыква.
6) Как солнцезащитный крем может быть антивозрастным?
«Такие средства, как правило, обладают высоким фактором защиты и содержат гиалуроновую кислоту, обеспечивающую дополнительное увлажнение», — поясняет дерматолог Людмила Заморева.
«Антиоксиданты в их формуле восстанавливают поверхностный барьер кожи и возобновляют производство коллагена, — говорит дерматокосметолог Ольга Тарасова. — А значит, усиливают защиту не только от солнца, но и от морщин, пигментных пятен и потери упругости».
7) Чем отличается средство после солнца от обычного крема для тела?
Лосьоны после солнца успокаивают, охлаждают и питают обезвоженную, стянутую кожу. Кроме этого, они ускоряют процесс восстановления кожи, поддерживая интенсивность загара и препятствуя шелушению.
«Содержащиеся в них антиоксиданты (экстракты ромашки, календулы, алоэ, зеленого чая, авокадо) снимают покраснения и помогают бороться с негативными последствиями солнечных лучей», — подчеркивает Ольга Тарасова.
 Зачем нужны солнцезащитные средства для волос?
Зачем нужны солнцезащитные средства для волос?
«В отличие от кожи волосы не вырабатывают защитный пигмент меланин, — напоминает стилист Ян Виикна. — Поэтому солнечные лучи уменьшают прочность кератина и разрушают структуру волос: те становятся чувствительными, ломкими, секущимися».
«Но витамины и масла в солнцезащитных средствах увлажняют и защищают волосы», — уверена стилист Ланна Камилина.

9) Есть ли способ нанести автозагар ровно?
«Распределите автозагар от ног к плечам на чистую гладкую кожу, — предлагает Ольга Тарасова. — А на сухие участки (колени, локти, щиколотки), где загар получается темнее, постарайтесь нанести более тонкий слой».
Если цвет все равно неровный, протрите кожу ватным тампоном, смоченным в лимонном соке. В завершение добавьте немного хайлайтера на плечи и ключицы.
10) Похоже, у меня аллергия на солнцезащитные средства для кожи вокруг глаз. Что делать?
«Аллергию могут вызывать светопоглощающие химические вещества: сложные эфиры парааминобензойной кислоты, циннаматы и авобензон, — отмечает дерматолог Людмила Заморева. — Их не должно быть в составе».
Ищите средства с пометками РАВА-fгее (без парааминобензойной кислоты), Mineral Screen (физический фильтр) или «Гипоаллергенно».
Материал предоставлен журналом InStyle.












